Cada año, más de un millón de personas mueren por tuberculosis, una enfermedad que muchos creen erróneamente controlada. En algunos países, se la considera cosa del pasado, como si fuera un vestigio de los sanatorios de principios del siglo XX. Sin embargo, el Mycobacterium tuberculosis —el microorganismo que la causa— sigue circulando activamente por todo el mundo. Y lo más inquietante es que ha aprendido a resistir no solo a los antibióticos, sino también al sistema inmunitario humano, incluso cuando este ha sido entrenado por una vacuna.
Un nuevo estudio científico ha desvelado una de las estrategias más sorprendentes del bacilo: la capacidad de "hacerse el muerto" dentro del cuerpo para no ser eliminado por la respuesta inmunitaria. Este hallazgo proviene de una investigación genética avanzada llevada a cabo en ratones vacunados y ha sido publicada en la revista npj Vaccines por un equipo internacional de universidades como Tufts, Utah y Harvard. Según concluyen los autores, la bacteria altera su funcionamiento genético y entra en una especie de letargo, lo que le permite resistir incluso cuando el organismo ya tiene memoria inmunitaria por vacunación o infección previa.
Una vacuna centenaria que protege... a medias
Más de 100 millones de bebés reciben cada año la vacuna BCG contra la tuberculosis. Esta fórmula, desarrollada hace más de un siglo a partir de una cepa atenuada de Mycobacterium bovis, protege eficazmente contra las formas graves de la enfermedad en la infancia. Sin embargo, su eficacia en adultos es mucho más limitada, especialmente contra la tuberculosis pulmonar, la más común y contagiosa.
A pesar de que la vacuna induce una respuesta inmunitaria potente —activando células T CD4+ y promoviendo la producción de interferón gamma—, esta defensa no siempre basta. Una de las grandes paradojas de la tuberculosis es que puede reactivarse años después, incluso en personas previamente infectadas o vacunadas. Lo que no se comprendía hasta ahora era por qué la bacteria podía sobrevivir a ese entorno hostil y aparentemente controlado.
Una estrategia genética de evasión
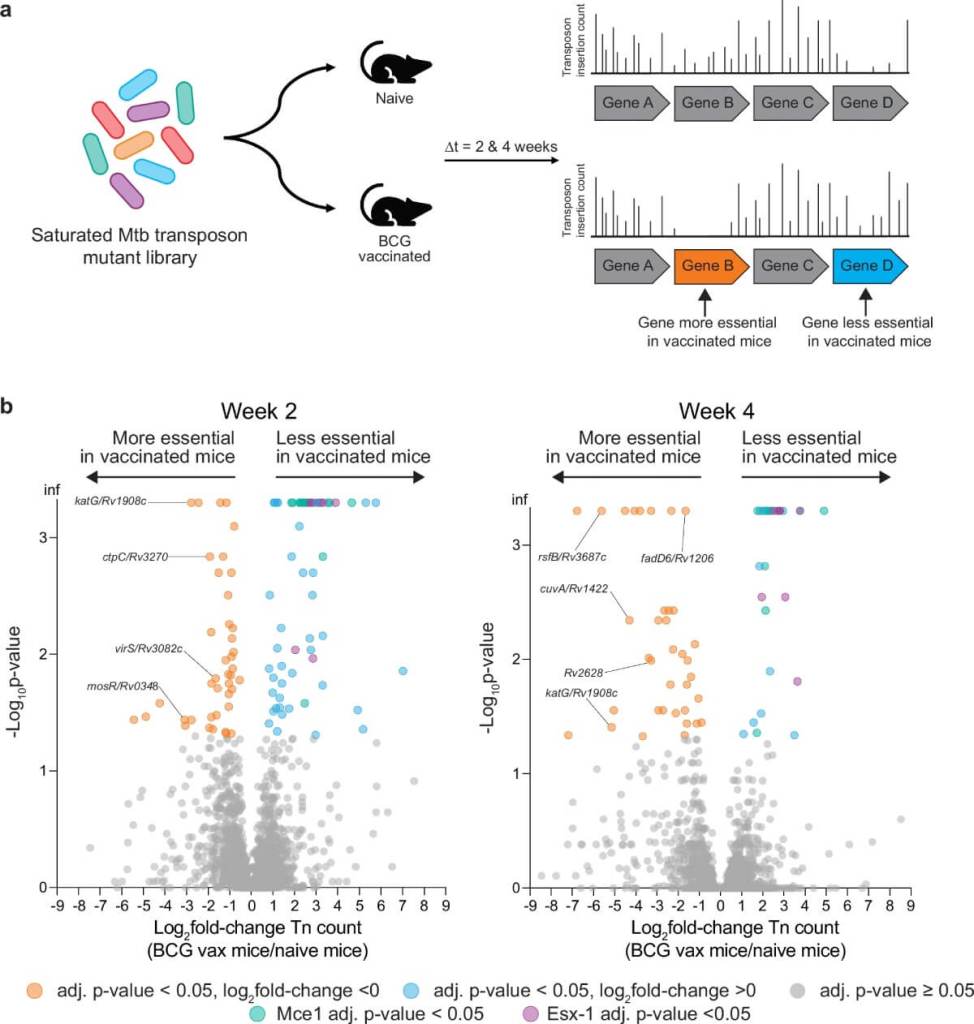
Para responder a esta pregunta, los investigadores utilizaron una herramienta de genética funcional llamada TnSeq (secuenciación por inserción de transposones). Este método permite analizar, de forma masiva, qué genes necesita la bacteria para sobrevivir en distintos entornos. El experimento consistió en introducir una biblioteca con miles de mutantes bacterianos en varios grupos de ratones: unos vacunados con BCG, otros con vacunas experimentales, otros previamente infectados y curados con antibióticos, y un grupo control sin inmunización.
Lo que encontraron fue inesperado. En los ratones inmunizados, la bacteria no necesitaba muchos de los genes considerados esenciales para la infección aguda. En cambio, dependía más de genes relacionados con la respuesta al estrés y la entrada en un estado de inactividad. Esto sugiere que, ante un sistema inmune preparado, el bacilo opta por reducir su actividad metabólica y mantenerse en un modo “silencioso” que le permite resistir hasta que las defensas del organismo disminuyen.
En palabras literales del estudio: “la bacteria requiere genes que le permiten adaptarse al estrés y detener su crecimiento al encontrarse con el entorno restrictivo inducido por la respuesta inmune adaptativa” .
Qué significa “hacerse la muerta”
Este comportamiento descrito en el paper no es metafórico. Lo que ocurre a nivel celular es que el bacilo activa un programa genético diferente al habitual. En lugar de desplegar sus sistemas de ataque —como los genes de virulencia Esx-1 y Mce1—, prioriza mecanismos de supervivencia que lo ayudan a soportar condiciones adversas, como baja disponibilidad de oxígeno, estrés ácido o limitaciones de nutrientes.
En los ratones vacunados, los genes de virulencia típicos resultaron ser “menos esenciales” para la bacteria, lo que indica que el patógeno no está intentando activamente infectar o propagarse, sino más bien mantenerse con vida sin llamar la atención. Esta estrategia coincide con lo que se observa en infecciones crónicas o latentes, donde el bacilo puede estar presente durante años sin provocar síntomas.
Una de las observaciones clave del estudio fue que los genes que permiten al bacilo importan ácidos grasos del huésped, esenciales durante la infección aguda, eran mucho menos necesarios en los animales vacunados. Esto refuerza la idea de que el microorganismo adopta un metabolismo de baja actividad para evitar ser detectado y eliminado .

¿Por qué esto complica el desarrollo de nuevas vacunas?
El hallazgo plantea un desafío importante: no basta con generar una fuerte respuesta inmunitaria, si la bacteria puede simplemente esperar a que esta desaparezca. Esto explicaría, en parte, por qué muchas vacunas que funcionan bien en modelos animales no logran proteger a largo plazo en humanos. Además, demuestra que distintas estrategias de vacunación generan diferentes presiones sobre la bacteria, lo que obliga al patógeno a modificar sus necesidades genéticas.
El estudio comparó varios tipos de inmunización, incluyendo la vía intravenosa, la subcutánea y una vacuna experimental llamada ΔLprG. En todos los casos, el bacilo demostró flexibilidad genética para adaptarse, lo que sugiere que no existe una única fórmula eficaz, sino que podría ser necesario combinar vacunas con tratamientos que obliguen al bacilo a salir de su estado de letargo.
Una oportunidad para diseñar mejores tratamientos
Aunque el estudio se hizo en modelos animales, sus implicaciones son amplias. Al conocer los genes que la bacteria activa durante su fase de evasión, los científicos podrían diseñar fármacos o adyuvantes que la obliguen a reactivarse, haciendo que la respuesta inmunitaria o los antibióticos sean más eficaces. Además, estas dianas genéticas podrían ayudar a desarrollar tests más precisos para identificar infecciones latentes, uno de los grandes problemas de salud pública actuales.
Según los autores, este enfoque centrado en el patógeno complementa los estudios tradicionales basados en el sistema inmune del huésped. “Comprender cómo M. tuberculosis sobrevive a la inmunidad inducida por la vacuna puede informar el desarrollo de nuevas vacunas o terapias adyuvantes”, escriben en el artículo .
¿Estamos más cerca de vencer a la tuberculosis?
Este trabajo aporta una pieza esencial al rompecabezas de la tuberculosis. Lejos de ser una enfermedad del pasado, sigue siendo la infección bacteriana más letal del mundo. La capacidad del bacilo para entrar en un estado de latencia y resistir tanto a la inmunidad como a los tratamientos es uno de los principales obstáculos para erradicarla.
Pero ahora, sabemos que ese “letargo” no es un accidente, sino una táctica evolutiva. Y como toda táctica, tiene puntos débiles. Si logramos identificarlos y atacarlos de forma específica, estaremos más cerca de desarrollar vacunas realmente efectivas para todas las edades. La clave podría estar en impedir que la bacteria “se haga la muerta” antes de que sea demasiado tarde.
Referencias
- Kimra S. James, Neharika Jain, Kelly Witzl, Nico Cicchetti, Sarah M. Fortune, Thomas R. Ioerger, Amanda J. Martinot & Allison F. Carey. TnSeq identifies genetic requirements of Mycobacterium tuberculosis for survival under vaccine-induced immunity. npj Vaccines (2025). DOI: 10.1038/s41541-025-01150-9.