Los insectos conocidos como membrácidos llevan décadas desconcertando a científicos y naturalistas. Sus pronotos —esas prolongaciones que brotan de su tórax— adoptan formas tan extravagantes que parecen piezas de joyería o esculturas alienígenas. Espinas afiladas, cuernos ramificados, esferas suspendidas o crestas que recuerdan a tridentes. Hasta ahora, las explicaciones propuestas para esta diversidad morfológica incluían el camuflaje, la imitación de otros animales, la defensa física o la señalización visual. Sin embargo, ninguna de estas hipótesis encajaba como explicación universal para las más de 3.000 especies conocidas.
Un nuevo estudio publicado en Proceedings of the National Academy of Sciences aporta una idea tan sorprendente como sugerente: los pronotos extremos podrían actuar como sensores de electricidad estática. El trabajo, liderado por Sam J. England y Daniel Robert, demuestra que los treehoppers no solo pueden detectar campos eléctricos generados por otros animales, sino que sus formas exageradas amplifican esa sensibilidad. Según los autores, “sugerimos que el pronoto de los membrácidos aumenta la sensibilidad a los estímulos eléctricos” y que esta capacidad podría haber influido en su evolución.
Un sentido invisible con un papel crucial
Los investigadores partieron de un hallazgo previo: especies como las abejas y las orugas son capaces de percibir campos eléctricos en el aire gracias a la deflexión de estructuras sensoriales llamadas setas. En el caso de los membrácidos, su pronoto está cubierto de setas mecanosensoriales, lo que llevó a plantear que podrían funcionar como un sistema de electrorecepción aérea.
El equipo midió las cargas electrostáticas de membracidos salvajes en Costa Rica, así como las de sus depredadores más comunes, las avispas, y de sus aliados, las abejas sin aguijón. Todos los insectos presentaban una carga neta, pero las avispas y las abejas diferían significativamente tanto en la magnitud como en la polaridad de esa carga. Esto abre la posibilidad de que los membrácidos distingan “amigos” de “enemigos” únicamente a partir de estas señales eléctricas.
Además, los experimentos de comportamiento revelaron que los membrácidos retroceden cuando se exponen a un campo eléctrico controlado, algo que no ocurre en las pruebas sin carga. Esto indica que su respuesta no es casual, sino que probablemente perciben la señal como un indicio de peligro.

La física detrás de los cuernos y espinas
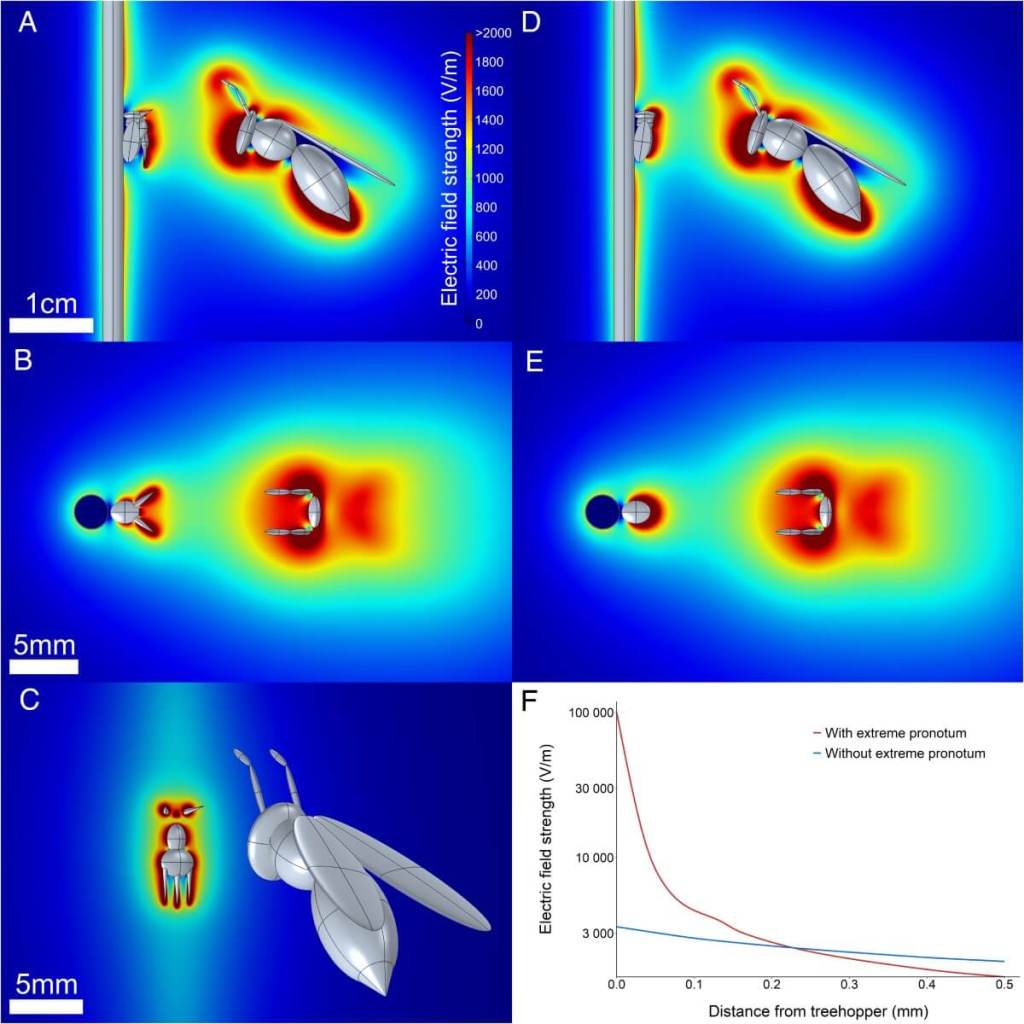
Mediante modelos computacionales tridimensionales, los autores simularon el encuentro entre un membrácido y una avispa cargada eléctricamente. El resultado fue revelador: las formas puntiagudas y alargadas del pronoto concentran el campo eléctrico en su superficie, aumentando la intensidad en dos órdenes de magnitud en comparación con un insecto de morfología lisa.
Este efecto de “lente electrostática” incrementa la probabilidad de que las setas mecanosensoriales reciban un estímulo lo bastante fuerte como para ser detectado. Según los investigadores, esta ventaja se multiplica de cinco maneras: por la geometría que concentra el campo, por la mayor superficie disponible para acumular carga, por el aumento del número de receptores posibles, por la proximidad a la fuente del campo y por la disposición variada de los receptores, que facilita la localización de la señal.
De forma interesante, a partir de cierta distancia, el pronoto extremo reduce la intensidad del campo en torno al insecto, lo que podría suponer una forma de camuflaje eléctrico frente a depredadores que también usen electrorecepción.
Estructuras sensoriales especializadas
Los análisis microscópicos confirmaron que el pronoto presenta dos tipos de setas: las de tipo erecto, que sobresalen perpendicularmente, y las de tipo fosa, situadas en pequeñas cavidades. Ambas parecen responder mecánicamente a estímulos eléctricos, pero las de tipo fosa ofrecen ventajas adicionales: carecen de zonas ciegas en su campo de detección y podrían incluso ayudar a discernir la polaridad de la carga.
Los experimentos con vibrometría láser demostraron que estas setas se mueven en respuesta a campos eléctricos oscilantes con frecuencias similares al batir de alas de las avispas depredadoras. Esto respalda la idea de que están adaptadas para detectar amenazas específicas en su entorno natural.
Implicaciones evolutivas
Si la electrorecepción ha influido en la morfología de los membrácidos, podría tratarse de un caso poco documentado de un sentido “invisible” que guía la evolución de estructuras complejas. La especialización sensorial podría haber favorecido la diversificación morfológica, explicando por qué este grupo presenta tanta variedad de formas extremas.
Los autores advierten, no obstante, que la electrorecepción no sería la única función del pronoto. Otras presiones selectivas, como la defensa física o la comunicación visual, probablemente actúan en paralelo. Lo novedoso es que ahora se suma un factor que hasta hace poco se creía irrelevante en ambientes terrestres: la detección de electricidad estática en el aire.
Un campo por explorar
Quedan abiertas numerosas preguntas. ¿Podrían otros insectos o incluso arácnidos con formas extremas estar usando mecanismos similares? ¿Existen adaptaciones específicas en la microestructura de sus cutículas para optimizar la captación eléctrica? El propio Dr. England reconoce que “nuestro estudio proporciona la primera evidencia de que el sentido electrostático puede impulsar la evolución morfológica, pero no podemos demostrarlo todavía”.
La idea de que la electricidad estática —algo que asociamos a chispas en días secos o a un globo pegado al pelo— pueda moldear la anatomía de un animal añade una dimensión inesperada a la comprensión de la evolución. En el caso de los membrácidos, lo que parecía un capricho estético de la naturaleza podría ser, en realidad, una sofisticada herramienta de supervivencia.
Referencias
- England SJ, Palmer RA, O’Reilly LJ, Chenchiah IV, Robert D. Electroreception in treehoppers: How extreme morphologies can increase electrical sensitivity. Proceedings of the National Academy of Sciences. 2025;122(30):e2505253122. doi:10.1073/pnas.2505253122.




