Cada año se generan millones de toneladas de residuos biológicos que terminan en vertederos o incinerados (cabello, lana, plumas, restos de tejidos animales). Todos comparten un componente clave: la queratina, una proteína resistente que podría reutilizarse en textiles, bioplásticos o ingeniería biomédica. Sin embargo, su rigidez y estructura compleja han hecho que extraerla y procesarla sea costoso y contaminante. Los métodos tradicionales requieren productos químicos fuertes, como la urea o el guanidinio, que dañan la proteína y dejan desechos difíciles de eliminar. El desafío era encontrar una forma más limpia y directa de aprovechar esos materiales sin degradarlos.
En un nuevo estudio, publicado en Nature Communications, un grupo de investigadores demostró que es posible extraer y regenerar queratina de manera sencilla utilizando una sal inorgánica común: el bromuro de litio (LiBr). Lo sorprendente es que esta sal no rompe las proteínas por contacto directo, sino que cambia la forma en que el agua interactúa con ellas. Al hacerlo, consigue que la proteína se despliegue de manera natural, sin necesidad de calor extremo ni compuestos tóxicos. Este hallazgo redefine cómo entendemos el proceso de “desnaturalización” de proteínas, un fenómeno que hasta ahora se explicaba casi exclusivamente por interacciones químicas entre el disolvente y la proteína.
El resultado es un sistema de reciclaje biológico que no solo evita residuos peligrosos, sino que también permite reutilizar el mismo compuesto salino una y otra vez sin pérdida de eficacia. La clave está en que el bromuro de litio no destruye la proteína, solo reorganiza su entorno.

Cómo una sal cambió lo que se sabía sobre las proteínas
Los investigadores descubrieron que el efecto del bromuro de litio no se debe a una reacción directa con la queratina, sino a una alteración en la estructura del agua. En condiciones normales, el agua forma una red estable de puentes de hidrógeno que ayuda a mantener el plegado de las proteínas. Pero cuando se añaden concentraciones altas de esta sal, esa red se interrumpe parcialmente. Parte del agua queda “atrapada” alrededor de los iones de litio y bromo, lo que reduce la cantidad de agua libre que sostiene la estructura original de la proteína. Esto hace que desplegar la proteína sea energéticamente más fácil.
Para entenderlo, los científicos realizaron experimentos térmicos y espectroscópicos junto con simulaciones moleculares. Los resultados mostraron que, a diferencia de los compuestos orgánicos tradicionales, el bromuro de litio no libera calor ni forma enlaces con las proteínas.
En cambio, cambia el comportamiento del agua a nivel molecular. Ese cambio, aunque sutil, modifica el equilibrio energético del sistema y hace que la proteína pierda su forma compacta y adopte una configuración más extendida.
Este proceso no depende del tipo de proteína: se observó el mismo comportamiento en moléculas pequeñas como enzimas, en proteínas intermedias como la fibronectina y en las más complejas, como la queratina del cabello o la lana. El orden de eficacia de las sales probadas fue claro: el bromuro de litio resultó el más potente, seguido del cloruro de litio y, muy por detrás, el bromuro de sodio. Es la primera vez que se demuestra que la entropía del agua, y no la química directa, puede gobernar la desnaturalización proteica.
De residuo a material: la queratina que se vuelve gel y luego sólido
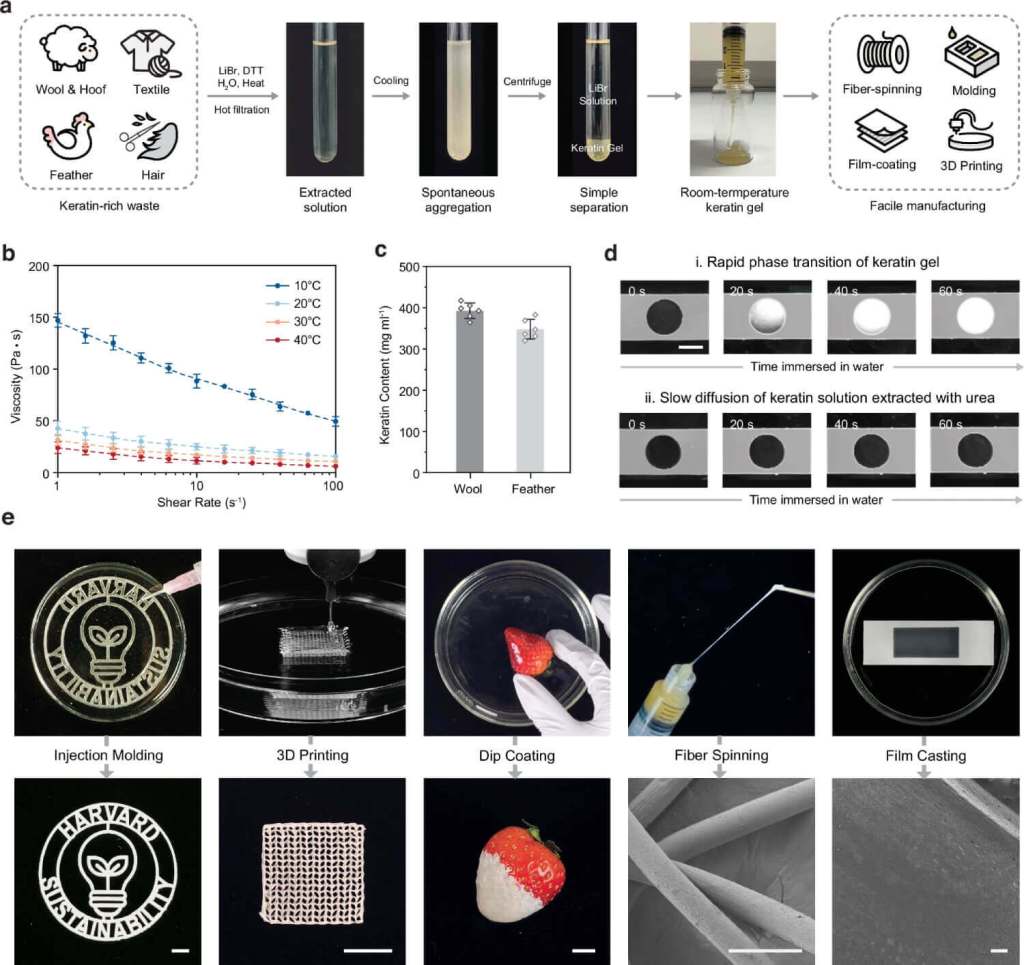
A partir de este mecanismo, el equipo diseñó un proceso para recuperar queratina de residuos naturales sin destruirla. Usando una solución concentrada de bromuro de litio y un reductor que rompe los enlaces de azufre, lograron extraer la proteína y obtener un gel denso y estable.
Este gel contiene entre 300 y 400 miligramos de queratina por mililitro, una concentración excepcionalmente alta para materiales de origen biológico. Lo más notable es que el gel se solidifica en segundos al entrar en contacto con agua.
Este comportamiento permite convertir el gel directamente en objetos sólidos sin pasos intermedios. La queratina recuperada puede moldearse, imprimirse en 3D o transformarse en películas, fibras o recubrimientos. A diferencia de los métodos tradicionales, no necesita eliminar residuos químicos antes de su procesamiento. En pocos minutos, un desecho blando y sin valor se convierte en un material sólido, moldeable y biocompatible.
La diferencia con las técnicas convencionales es abismal. Mientras que con compuestos orgánicos se obtienen polvos dispersos que requieren liofilización y purificación, con este método se obtiene un material listo para usar. Es un proceso rápido, eficiente y reutilizable que podría aplicarse industrialmente con menor costo y menor impacto ambiental.
Materiales ajustables y reciclaje completo del proceso
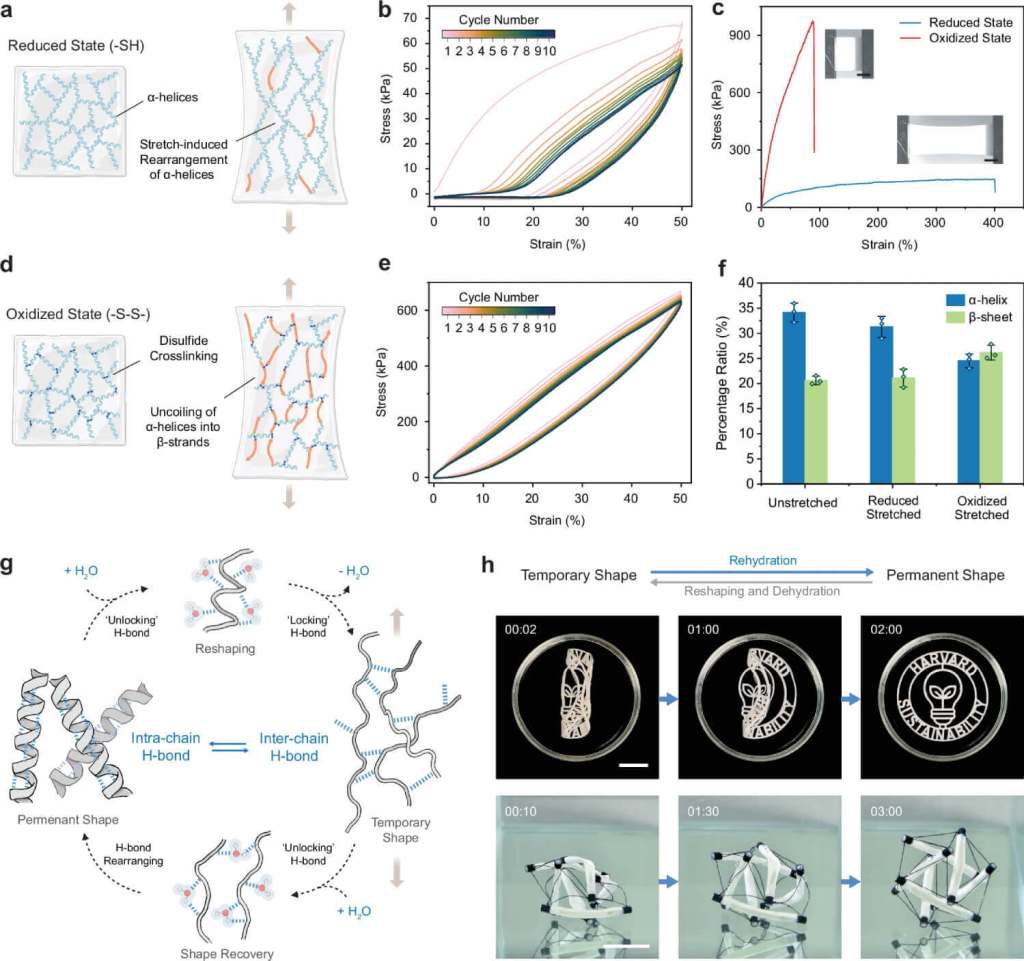
El material obtenido no solo es sólido, sino también adaptable. Su estructura puede modificarse según el grado de unión entre las cadenas de queratina. Si se mantiene en estado reducido, el material es flexible y resistente, similar a una goma blanda. Si se oxida, se vuelve más rígido y elástico, con mayor módulo de tracción.
Esta variabilidad permite fabricar desde fibras extensibles hasta piezas estructurales más firmes. Los investigadores incluso demostraron que el material puede “recordar” su forma original y recuperarla al hidratarse.
Además de sus propiedades mecánicas, el proceso es completamente reciclable. Como el bromuro de litio no reacciona químicamente con la proteína, puede separarse fácilmente del gel y reutilizarse. En las pruebas, la misma solución se usó en al menos cinco ciclos de extracción sin perder concentración ni eficacia. Las mediciones térmicas confirmaron que el compuesto se mantiene estable, lo que elimina la necesidad de producir nuevos lotes o desechar residuos.
Este enfoque reduce drásticamente el uso de químicos y las emisiones asociadas a la obtención de proteínas a partir de fuentes animales. En comparación con los métodos tradicionales, el nuevo sistema muestra una huella ambiental mucho menor y un ahorro considerable de energía y recursos. El mismo líquido que extrae la proteína puede usarse repetidamente sin generar contaminación.
Un avance científico con impacto ambiental y económico
El descubrimiento tiene implicaciones amplias más allá de la queratina. Al comprender cómo los iones de una sal pueden modificar la red del agua y, con ello, el comportamiento de las proteínas, se abre una vía para rediseñar muchos procesos industriales y biomédicos.
La idea de aprovechar el entorno acuoso en lugar de atacar directamente las moléculas podría aplicarse en campos como la farmacología, la alimentación o el desarrollo de nuevos materiales biodegradables. Este estudio redefine la forma de entender el papel del agua en la biología y la ingeniería de materiales.
Desde una perspectiva práctica, el proceso ofrece una solución al enorme problema del desperdicio proteico. Restos de lana, plumas o cabello que hoy se descartan podrían convertirse en productos de alto valor, desde textiles ecológicos hasta componentes médicos. Todo mediante un sistema de bajo costo, sin disolventes tóxicos y con capacidad de regenerar sus propios reactivos. Si logra escalarse, esta tecnología podría cambiar la forma en que se gestionan los residuos biológicos a nivel industrial.
El trabajo demuestra que los grandes cambios tecnológicos a veces no dependen de nuevos materiales, sino de entender mejor los que ya existen. Al observar con detalle la interacción entre agua, sales y proteínas, los científicos descubrieron un camino más eficiente y sustentable para dar nueva vida a los desechos biológicos.
Referencias
- Wang, Y., Liu, J., Peters, M.M. et al. Entropy-driven denaturation enables sustainable protein regeneration through rapid gel-solid transition. Nat Commun 16, 6907 (2025). doi: 10.1038/s41467-025-61959-9




