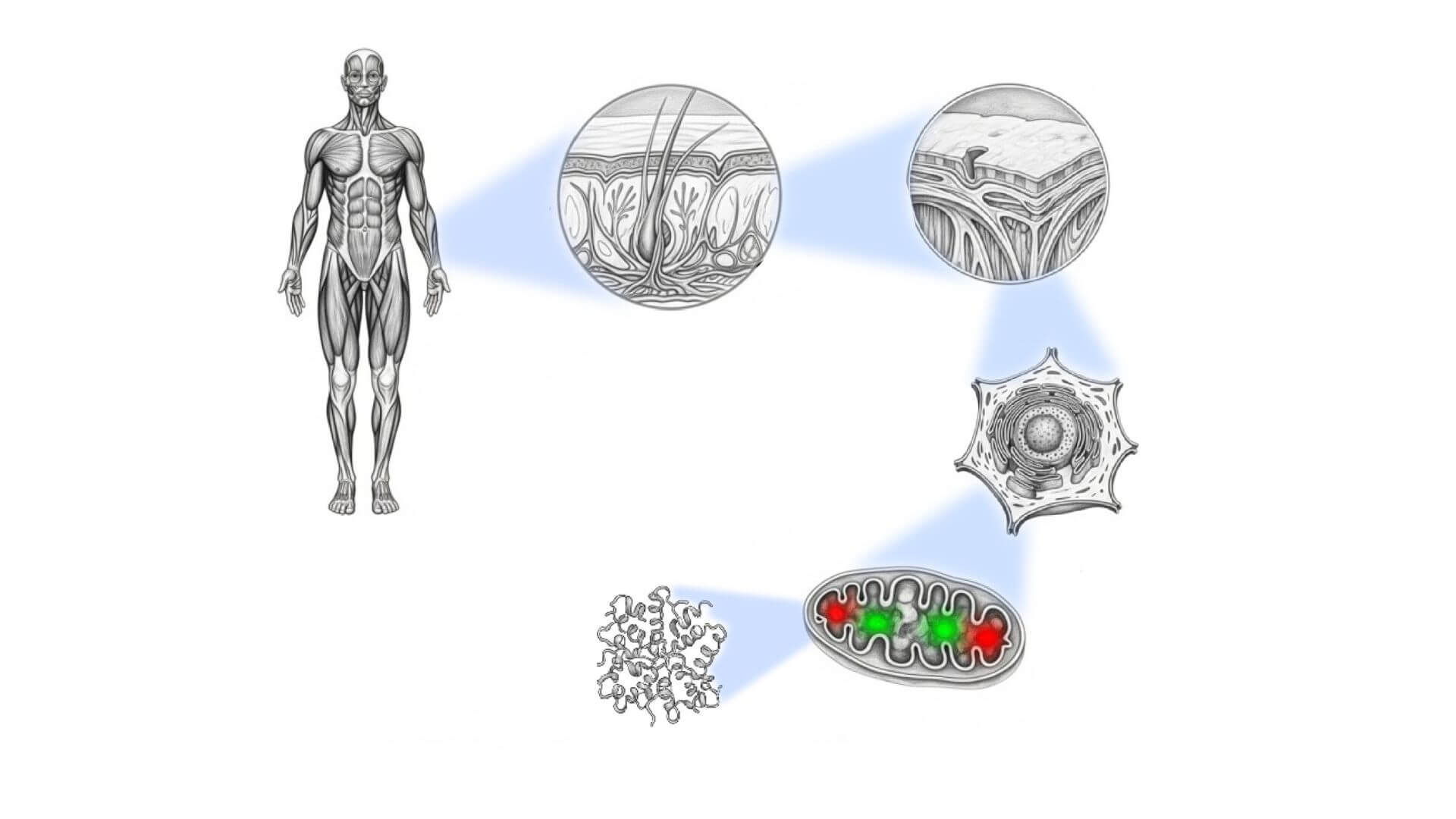
Ya conocemos que la célula es la unidad vital. La célula crece, se transforma y divide para crear distintos tejidos especializados, o se recombina con otras para generar variaciones en su carga genética. Mucho de lo que se conoce de la célula proviene de la microscopía, bien sea fotónica o electrónica, que ha permitido determinar sus distintas estructuras. Ahora el uso combinado de un grupo de técnicas de microscopía englobadas bajo el nombre de criomicroscopía correlativa, va a permitir estudiar a la vez la dinámica de distintos procesos celulares y la estructura, incluso a resolución atómica, de los orgánulos y complejos macromoleculares que los controlan.
La microscopía fotónica y la célula
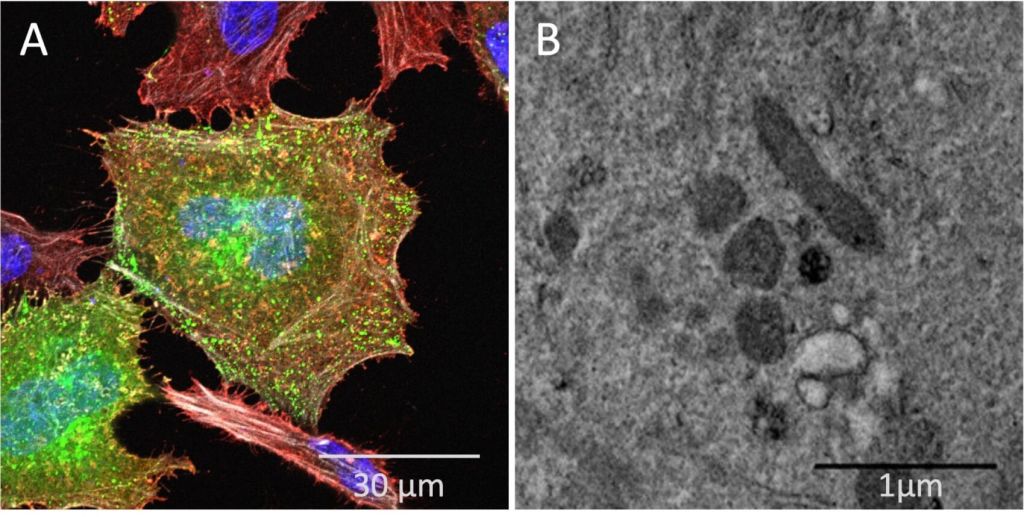
Ninguna otra técnica nos ha permitido conocer tan bien la célula como las técnicas de microscopía. La primera en desarrollarse fue la microscopía fotónica, denominada también óptica, cuyo origen se puede trazar al siglo XVII con los clásicos trabajos de Hooke y Leeuwenhoek. El desarrollo de la microscopía fotónica se ha mantenido constante hasta nuestros días y su mayor exponente son las novedosas técnicas de superresolución, que gracias a inteligentes “trucos” han podido sobrepasar los límites teóricos de resolución, que vienen dados fundamentalmente por la longitud de onda de la luz que se utiliza para estudiar las muestras, y que suele ser en el mejor de los casos unos 200 nm (Figura 1A). Estos nuevos límites, del orden de 10-20 nm, son, sin embargo, insuficientes para poder resolver las moléculas biológicas que están detrás de cada uno de los procesos que se pretenden estudiar, y que poseen un tamaño medio entre 5 y 30 nm. A pesar de esa limitación, la microscopía fotónica tiene la ventaja de permitir visualizar células vivas y así seguir procesos celulares, que son por naturaleza dinámicos.
La microscopía electrónica y la célula
La otra técnica de microscopía que ha causado un fuerte impacto en el estudio celular es la microscopía electrónica, nacida en los años 30 del pasado siglo. Desde el punto de vista conceptual, la microscopía fotónica y electrónica son muy parecidas: ambas usan una fuente de radiación (fotones en un caso, electrones en el otro), que es conducida por lentes (ópticas en un caso, electromagnéticas en el otro), transmitida a través de la muestra y recogida por un sistema de detección. La mayor ventaja de la microscopía electrónica radica en el uso de electrones, que con una longitud de onda típica del orden de 0,001 – 0,004 nm, permiten en un principio resolver los átomos de las moléculas biológicas, es decir, determinar su estructura atómica.
La mayor desventaja es la gran cantidad de energía que los electrones introducen en las muestras, y que afecta particularmente a las biológicas, cuyas estructuras dependen de la conservación de los enlaces débiles que se producen entre los átomos de esas moléculas y con las del agua que las rodean. El mantenimiento del agua que solvata las muestras es fundamental, pero es un enemigo del microscopio electrónico, que requiere de un alto vacío para que los electrones puedan ser conducidos por todo el sistema óptico del microscopio y sean capaces de atravesar la muestra. Durante los primeros cincuenta años de la microscopía electrónica se trabajó en buscar maneras de eliminar el agua de los sistemas biológicos a estudiar sin que esto afectase grandemente a las estructuras que se pretendían analizar, y fruto de ese esfuerzo, que incluye técnicas de fijación, deshidratación, inclusión en resina, proviene una gran parte de lo que conocemos sobre el núcleo, el retículo endoplásmico, las mitocondrias, … (Figura 1B).
La criomicroscopía electrónica
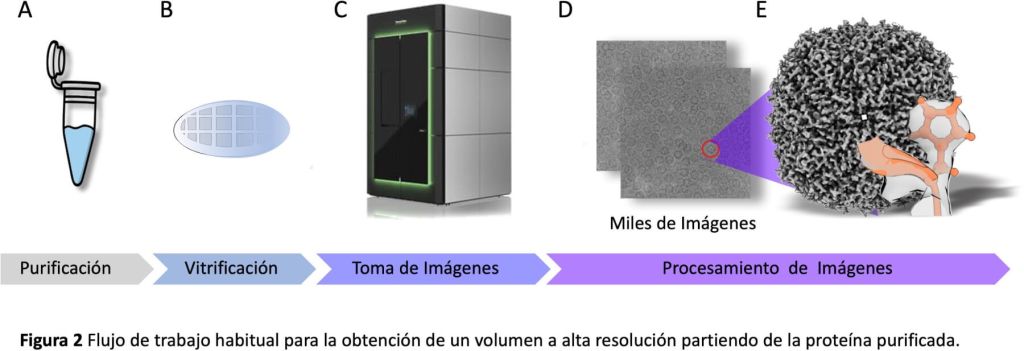
Para conseguir extraer toda la información biológica de una manera fiel y a la mayor resolución posible, había que buscar maneras de conservar la muestra biológica en el agua que la rodea, y extraer la mayor información posible sin utilizar muchos electrones. A este trabajo se han dedicado un gran número de investigadores desde los años 80. Como resumen de este largo proceso, se puede decir que pronto se descubrió que la mejor manera de mantener la muestra biológica en su forma hidratada es la de congelarla a muy baja temperatura (~-180 °C), a una velocidad de congelación tan rápida que al agua no le dé tiempo a cristalizar.
Las moléculas, purificadas previamente (Figura 2A), se ven así rodeadas de un hielo vítreo (el proceso se llama vitrificación) que las mantiene en un estado cercano al fisiológico (Figura 2B). A partir de ese momento, la muestra se conserva a esa baja temperatura, incluso dentro del microscopio electrónico, y por eso esta nueva técnica se denomina criomicroscopía electrónica (crioME), aunque bajo ese nombre se incluyen también mejoras en el microscopio electrónico (ahora criomicroscopio electrónico; Figura 2C y D), en la forma de tomar las imágenes y en la de procesarlas. Sin extendernos en este asunto, baste decir que gracias a estos avances la crioME se ha convertido en la más poderosa herramienta estructural de nuestros días, capaz de determinar la estructura a nivel atómico de casi cualquier molécula biológica (Figura 2).
La criotomografía electrónica y la “sociología celular”
Esos avances se han obtenido gracias a la adquisición y procesamiento de moléculas en principio idénticas (como las que se muestran en la Figura 2D), que se purifican de extractos celulares, y de las que después de un procesamiento se obtiene una estructura como la que muestra la Figura 2E. Sin embargo, lo que se discute en este artículo es el análisis de los componentes celulares tal como se disponen en la célula, para entender no solo su estructura sino la relación entre ellos. Y es que cada vez es más evidente que la disposición de los distintos orgánulos y estructuras celulares no tiene nada de azaroso, sino que responde a las necesidades celulares del momento, que pueden cambiar dependiendo de los procesos que se estén llevando a cabo. A este conjunto cambiante de relaciones entre los distintos componentes celulares se le ha definido como “sociología celular” y es una de las nuevas áreas de estudio a la que la microscopía puede contribuir de manera única.
Para estudiar esta “sociología celular”, no queda otra que determinar su estructura directamente, y eso se puede conseguir mediante técnicas tomográficas parecidas a las que se usan en un hospital para reconstruir el cuerpo de un paciente. En pocas palabras, la tomografía electrónica consiste en tomar imágenes de la muestra a reconstruir en gran número de ángulos sobre un mismo eje y utilizar esas imágenes, mediante complejos tratamientos matemáticos, para reconstruir la estructura a visualizar (Figura 3A).
Para ello, y gracias a su poder de resolución, la criotomografía electrónica (crioTE) se ha convertido en una herramienta muy poderosa, aunque hay un inconveniente y es que debido a la alta interacción de los electrones con la materia, el espesor de la muestra a reconstruir no puede ser muy grande (400-500 nm como mucho). Para ello se debe recurrir en ocasiones al adelgazamiento de la muestra, que se realiza con aparatos como el que se discutirá en un momento. El procesamiento tomográfico de muestras da lugar a imágenes como la que se muestra en la Figura 3B, en la que se puede reconocer sin problemas distintos componentes celulares, con la ventaja de que se observan tal como son, sin ningún tipo de tratamiento que afecte a su estructura (compárese esta figura con la Figura 1B, obtenida con los métodos clásicos en los que el agua es eliminada).
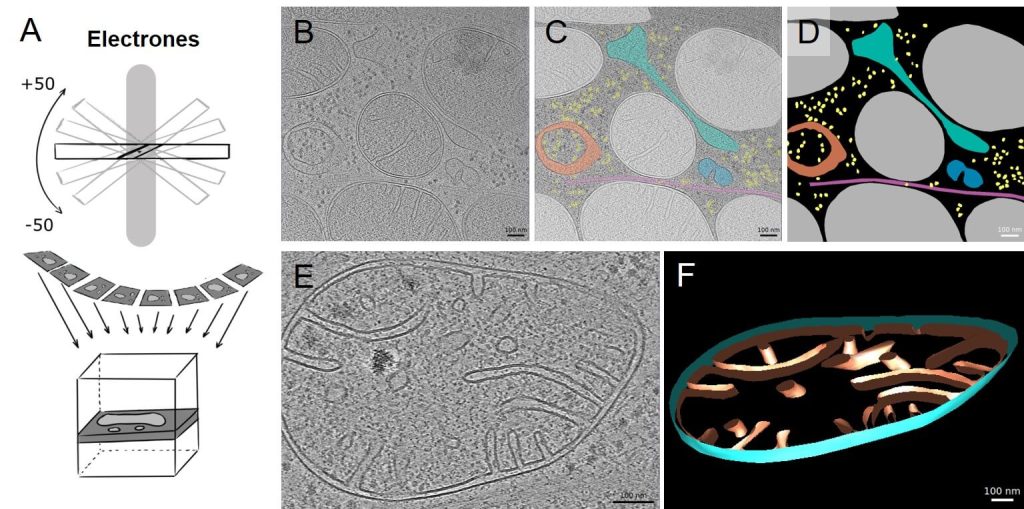
Las modernas técnicas de tratamiento de imagen, a las que ahora se incluye la inteligencia artificial, permiten una interpretación de las imágenes en el contexto celular como la que se muestra, de una manera simple, en la Figura 3C. Estas imágenes pueden ser tratadas posteriormente para conseguir más información. Por ejemplo, se pueden analizar las poblaciones de ribosomas y estudiar qué cerca están respecto a un determinado organelo, o simplemente “extraerlos” de la reconstrucción tomográfica y procesarlos como se ha hecho con las partículas de la Figura 2A para obtener una estructura final del tipo que se muestra en la Figura 2E. En definitiva, somos capaces de determinar, incluso a nivel atómico, las estructuras de moléculas dentro de su contexto celular.
La criomicroscopía correlativa
Ahora disponemos de sofisticadas técnicas de microscopía fotónica que nos permiten, mediante la introducción de una sonda fluorescente en una molécula biológica determinada, seguir su suerte durante un proceso celular. A la vez, gracias a la crioTE, podemos determinar la estructura, a muy alta resolución, de la zona de la célula que está involucrada en el proceso celular que hemos seguido por microscopía fotónica.
La pregunta es, ¿podemos hacer esos dos análisis (el dinámico mediante microscopía fotónica y el estructural mediante crioME), literalmente de la misma estructura, en una célula determinada? La respuesta es que ahora sí, gracias a la exquisita correlación de esas técnicas. La técnica de microscopía correlativa no es nueva, pero gracias a los nuevos avances tecnológicos, casi todos ya citados en este artículo y esquematizados en la Figura 4A, se está llevando a unos niveles impensables hace pocos años. La idea general es conseguir adherir células de un cultivo celular a la rejilla del microscopio electrónico, algo perfectamente factible en la actualidad, y hacerlo con una molécula fluorescente que marque específicamente la molécula biológica involucrada en el proceso celular a seguir. El cultivo celular se vitrifica (Figura 4A, 1) y se busca en él mediante criomicroscopía fotónica las células que muestran más favorablemente el proceso celular que se pretende estudiar (Figura 4A y B, 2). Los eventos interesantes se analizan en profundidad y se registran en un preciso sistema de coordenadas tridimensionales que permite conocer, dentro del cultivo celular de la rejilla, no solo dónde están las células interesantes que acabamos de estudiar, sino la el área dentro de cada una de ellas donde se encuentra ese evento.

El siguiente paso sería determinar la estructura tridimensional de esos eventos mediante crioTE, pero el espesor de la mayor parte de las células es demasiado grande (normalmente de varios µm) para que los electrones puedan atravesarla, así que hay que someterla a un proceso de “adelgazamiento” para el que se utiliza un cañón de iones de galio que elimina el área de la célula donde no está aquello que se pretende estudiar (Figura 4A y B, 2), y deja así una capa fina de material que sí es susceptible a su manejo por crioTE (Figura 4A y B, 4), para su reconstrucción tridimensional por técnicas tomográficas.
Conclusiones
Los nuevos desarrollos tecnológicos tanto en la preparación de las muestras como en la adquisición de información y su posterior procesamiento, tanto en la microscopía fotónica como la electrónica, han permitido relacionarlas con precisión para extraer lo mejor de cada una de ellas en la comprensión del papel de los componentes celulares en el desarrollo de los distintos procesos que acaecen en la célula.
Referencias
- José Javier Conesa y Francisco Javier Chichón (2019). Criomicroscopía correlativa tridimensional de tomografía de rayos X blandos. Revista de la SEBBM. Vol. 201, pp. 14-17.
- José Jesús Fernández (2019). Criotomografía electrónica. Revista de la SEBBM. Vol. 201, pp. 18-22.
- Jaime Martín-Benito y Rocío Arranz (2019). Determinación estructural mediante criomicroscopía electrónica de partículas individuales y procesamiento de imágenes. Revista de la SEBBM. Vol. 201, pp. 24-28.

José María Valpuesta Moralejo
Doctor en Ciencias Biológicas


Rocío Arranz Ávila
Doctora en Biología Molecular


Francisco Javier Chichón García
Doctor en Ciencias Biológicas


David Delgado Gestoso
Graduado en Biología. Máster en Biotecnología


Olivia Muriel López
Doctora en Bioquímica, Biología Molecular y Biomedicina. Investigadora del Programa ComFuturo de la Fundación General CSIC


Jonathan Gabriel Piccirillo
Graduado en Biología. Máster en Biología Molecular y Celular. Máster en Investigación Multidisciplinaria


Noelia Zamarreño Fernández
Técnico Superior en Anatomía Patológica y Citología