En los años 2000, la optogenética revolucionó la neurociencia al permitir “encender” y “apagar” células a voluntad utilizando la luz. Esta técnica, que combina genética y óptica, introdujo proteínas sensibles a la luz en células específicas, permitiendo su activación al aplicar pulsos de luz. La optogenética cambió el paradigma en el control neuronal, permitiendo estudiar circuitos neuronales con una precisión sin precedentes, lo que abrió las puertas a una mejor comprensión del cerebro.
Sin embargo, la optogenética puede presentar ciertas limitaciones. Para funcionar, requiere la introducción de proteínas que responden a la luz que no existen naturalmente en el cuerpo humano. Además, necesita el uso de fibras ópticas implantadas cerca del tejido que queremos estimular, lo que puede resultar invasivo y limitar su aplicación en organismos vivos o en zonas profundas del cuerpo.
Años después surgió como técnica alternativa la magnetogenética. Esta técnica emergente utiliza campos magnéticos en lugar de luz para activar células de forma remota. Lo más interesante es que no necesita implantes invasivos porque los campos magnéticos son capaces de penetrar en los tejidos, lo que la convierte en una herramienta prometedora para aplicaciones biomédicas.

Magnetogenética
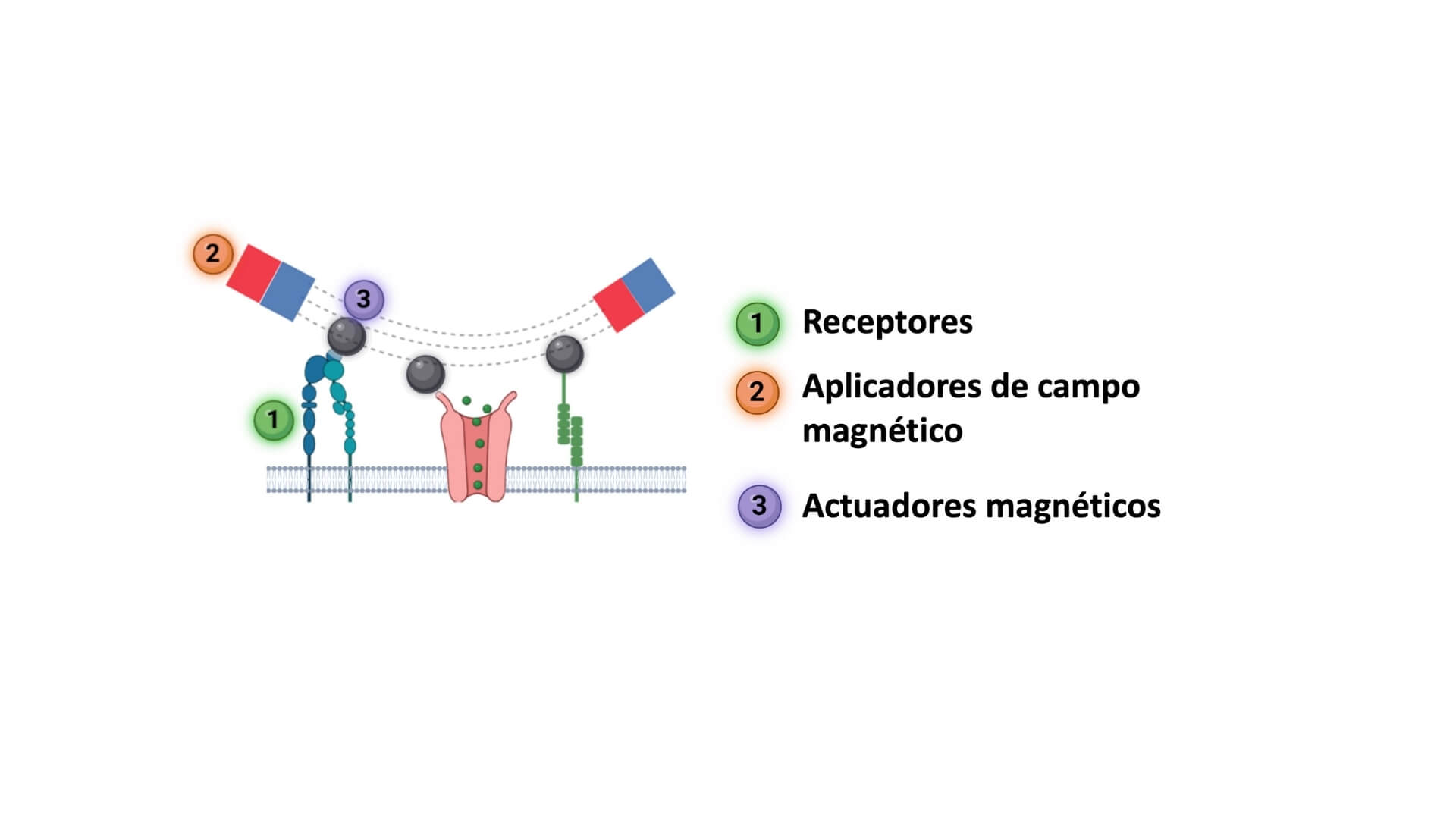
La magnetogenética emplea además de los campos, actuadores magnéticos. Estos actuadores pueden ser nanopartículas magnéticas diseñadas para que se dirijan de manera selectiva a receptores sensibles a la fuerza situados en la membrana celular. 1 Cuando se aplica un campo magnético externo, las nanopartículas ejercen una tracción mecánica sobre estos receptores, activándolos como si se tratara de una señal natural.
Imaginemos una viruta metálica adherida a una zona de la célula que responde a la tensión. Al acercar un imán, la viruta se mueve, generando una fuerza que activa el receptor. Esta técnica permite simular estímulos mecánicos de manera remota, lo que abre un abanico de posibilidades para el estudio y manipulación de funciones celulares.

¿Qué podemos activar?
Nuestras células son capaces de detectar diversos estímulos externos, como pueden ser la presión y el estiramiento. Esta capacidad es clave para funciones como el tacto, la audición o la regulación de la presión arterial. Los responsables de esta detección son los canales mecanosensibles o mecanorreceptores, los cuales se activan en respuesta a fuerzas físicas. Una vez activados, desencadenan una cascada de señalización que es capaz de comenzar o guiar procesos biológicos.
La magnetogenética permite estimular artificialmente estos canales, desencadenando las mismas respuestas celulares. Por ejemplo, se puede activar una neurona si aplicamos un campo magnético que ejerza fuerza sobre las nanopartículas magnéticas adheridas a sus receptores mecanosensibles. Es por ello que esta técnica puede tener aplicaciones en investigación básica, pero también en aplicada, donde podría llegar a utilizarse para tratar trastornos de forma no invasiva y remota.
Piezo1: el canal de moda
Uno de los canales mecanosensible más estudiados es Piezo1, descubierto en 2010 por Ardem Patapoutian, quien recibió el Premio Nobel de Fisiología o Medicina en 2021 por su descubrimiento. Participa en procesos tan importantes como la regulación de la presión arterial y la percepción del tacto, y está involucrado en procesos patológicos como el desarrollo de ciertos tumores. Por ello, en los últimos años se ha convertido en una diana terapéutica de gran interés.
Gracias a la magnetogenética ahora es posible activar Piezo1 de manera remota y específica, lo que permite estudiar en tiempo real su función. Esta técnica ha sido utilizada tanto en células en cultivo como en roedores, demostrando que al aplicar el campo magnético, las neuronas son capaces de responder tras la activación de estos receptores. 2,3 Por ejemplo, ha sido recientemente demostrado que con esta técnica se puede realizar una estimulación cerebral profunda, mitigando los síntomas motores causados en un modelo de ratones con Parkinson sin utilizar implantes.4 Una de las grandes ventajas de esta técnica es que los sistemas de imanes utilizados son relativamente económicos, pueden utilizarse en modelos animales de manera remota y no generan calor.
Retos
Como toda tecnología emergente, la magnetogenética se enfrenta a muchos desafíos. De hecho, ha sido duramente criticada por la falta de reproducibilidad de algunos estudios y por la publicación de artículos que justifican de manera teórica que el uso de ciertos nanoactuadores magnéticos no es compatible con la generación de fuerzas suficientes para provocar la apertura de mecanorreceptores. 1,5,6 Es por ello que uno de los principales retos a los que se enfrenta la magnetogenética es el diseño de actuadores magnéticos que puedan dirigirse con precisión a los receptores deseados y generen suficiente fuerza para abrirlos. Además, a día de hoy muchos de los estudios se han realizado modificando los receptores previamente para que las nanopartículas se unan exclusivamente a ellos, lo que como en la optogenética, puede presentar problemas a la hora de trasladar esta tecnología a la clínica. El reto está, por tanto, en demostrar en modelos animales que se pueden activar los canales sin modificarlos previamente.
Un futuro prometedor
A pesar de que la magnetogenética aún está en desarrollo, su potencial es enorme. En el futuro, podría permitir tratamientos no invasivos para enfermedades neurológicas, como la epilepsia, mediante la activación controlada de neuronas específicas. También se podría utilizar para controlar funciones celulares con precisión y explorar nuevas dianas terapéuticas.
Quiero expresar mi más profundo agradecimiento a todas las personas de mi equipo de investigación. Gracias a su dedicación y esfuerzo estamos logrando avanzar un paso más en este fascinante campo de la magnetogenética.
Referencias
- (1) Del Sol-Fernández, S.; Martínez-Vicente, P.; Gomollón-Zueco, P.; Castro-Hinojosa, C.; Gutiérrez, L.; Fratila, R. M.; Moros, M. Magnetogenetics: Remote Activation of Cellular Functions Triggered by Magnetic Switches. Nanoscale 2022, 14 (6), 2091–2118. doi: 10.1039/D1NR06303K
- (2) Sol-Fernández, S. Del; Simone, M. De; Fernández-Afonso, Y.; Garcia-Gonzalez, D.; Martínez-Vicente, P.; van Zanten, T. S.; Fratila, R. M.; Moros, M. MagPiezo: A Magnetogenetic Platform for Remote Activation of Endogenous Piezo1 Channels in Endothelial Cells. July 4, 2025. doi: 10.1101/2025.06.30.661957
- (3) Lee, J.; Shin, W.; Lim, Y.; Kim, J.; Kim, W. R.; Kim, H.; Lee, J.-H.; Cheon, J. Non-Contact Long-Range Magnetic Stimulation of Mechanosensitive Ion Channels in Freely Moving Animals. Nat Mater 2021, 20 (7), 1029–1036. doi: 10.1038/s41563-020-00896-y
- (4) Shin, W.; Lee, Y.; Lim, J.; Lee, Y.; Lah, J. D.; Lee, S.; Lee, J.; Yu, R.; Lee, P. H.; Lee, J.-H.; Kwak, M.; Cheon, J. Nanoscale Magneto-Mechanical-Genetics of Deep Brain Neurons Reversing Motor Deficits in Parkinsonian Mice. Nano Lett 2024, 24 (1), 270–278. https://doi.org/10.1021/acs.nanolett.3c03899.
- (5) Nimpf, S.; Keays, D. A. Is Magnetogenetics the New Optogenetics? EMBO J 2017, 36 (12), 1643–1646. https://doi.org/10.15252/embj.201797177.
- (6) Meister, M. Physical Limits to Magnetogenetics. Elife 2016, 5, e17210. https://doi.org/10.7554/eLife.17210.

María Moros Caballero
Científico Titular del CSIC. Doctora en Química