La medición precisa de la temperatura en el interior de los tejidos biológicos es una necesidad creciente en biomedicina. Los procesos fisiológicos y patológicos están acompañados de variaciones térmicas muy sutiles, y su detección puede proporcionar información crítica en áreas como el diagnóstico de tumores, la monitorización de terapias o el estudio del metabolismo celular. Hasta ahora, la mayoría de las técnicas de termometría lumínica se limitaban a obtener imágenes en dos dimensiones, lo que supone un obstáculo para comprender la complejidad de la difusión del calor en un medio que, por naturaleza, es tridimensional.
En este contexto, nuestro estudio presenta un avance clave: el desarrollo de una estrategia capaz de obtener imágenes térmicas en tres dimensiones utilizando nanotermómetros luminiscentes y algoritmos de aprendizaje automático.
Publicado en Nature Communications, este trabajo demuestra que es posible extraer información de profundidad y temperatura a partir de un único registro lumínico, superando limitaciones de métodos anteriores y mostrando la viabilidad de una tecnología no invasiva para la caracterización térmica en sistemas biológicos vivos.
Nanotermometría luminiscente: fundamentos y limitaciones previas
La nanotermometría luminiscente se basa en el uso de nanopartículas que, cuando son excitadas por un láser externo, tienen una emisión dependiente de la temperatura. El carácter mínimamente invasivo de la técnica ha permitido estudiar fenómenos en microelectrónica, catálisis y, sobre todo, en sistemas biológicos complejos.
Sin embargo, hasta ahora, el principal obstáculo era la imposibilidad de reconstruir mapas térmicos tridimensionales. Las técnicas disponibles ofrecían únicamente proyecciones bidimensionales o requerían procesos de adquisición largos y costosos, con pérdida de resolución temporal.
Este vacío limitaba el potencial diagnóstico y clínico de la nanotermometría, pues muchos procesos de interés —como la detección de inflamaciones o el seguimiento de terapias térmicas— ocurren en estructuras internas que no pueden representarse adecuadamente en dos dimensiones.
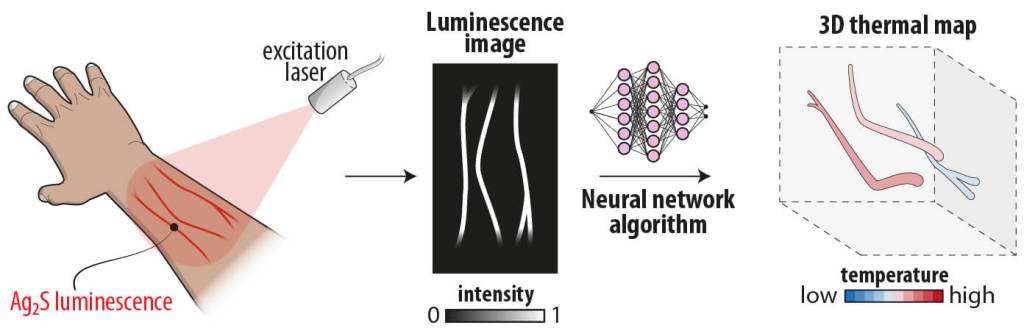
Selección de nanotermómetros y principio de la técnica
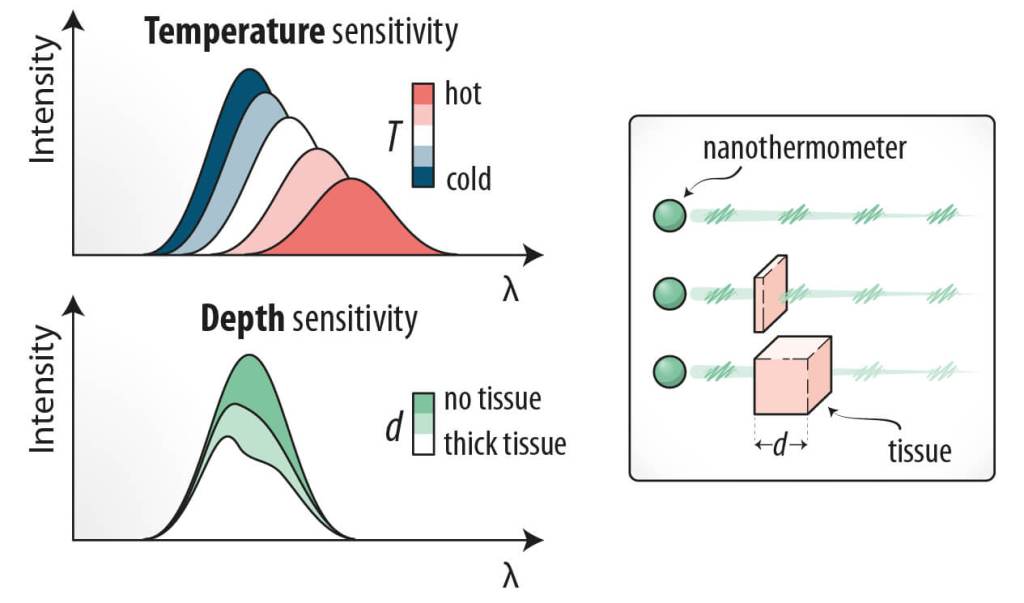
El diseño de esta estrategia se basó en el uso de nanopartículas de sulfuro de plata (Ag₂S). Estas cumplen tres requisitos esenciales: su emisión se produce en el rango infrarrojo cercano, lo que permite mayor penetración en tejidos; su espectro presenta cambios sensibles dentro del rango fisiológico de temperatura (20–50 °C); y la emisión se solapa con una de las bandas de absorción del agua, lo que hace que la señal se distorsione en función del grosor del tejido atravesado.
Este último punto es crucial, ya que las distorsiones espectrales inducidas por el tejido contienen información sobre la profundidad a la que se encuentran las nanopartículas. De esta manera, la señal de luminiscencia no solo refleja cambios de temperatura, sino también la ubicación espacial de las partículas en el interior del organismo. El reto consistía en procesar esas señales complejas y extraer de ellas información fiable de temperatura y profundidad al mismo tiempo.
El papel del aprendizaje automático
Para resolver la dificultad anterior, se entrenó un algoritmo compuesto por una red neuronal convolucional combinada con una red densa (CNN+DNN). Este enfoque aprovecha la capacidad de las redes convolucionales para identificar patrones en datos espectrales y la potencia de las redes densas para establecer relaciones no lineales entre múltiples variables.
El algoritmo fue entrenado con un conjunto de datos de más de 200.000 espectros obtenidos en condiciones controladas, utilizando tanto tejidos artificiales (phantoms) como muestras reales de cerdo, pollo y vaca. Durante la calibración se modificaron sistemáticamente la temperatura y el espesor del tejido, de modo que el sistema aprendiera a diferenciar los efectos de ambas variables en la señal de luminiscencia.
El resultado fue un modelo capaz de predecir la temperatura con una precisión de 0,45 °C y la profundidad con una resolución de 0,25 mm, en los tejidos y condiciones evaluadas.
Validación experimental en tejidos y sistemas vivos
La validación inicial se realizó introduciendo capilares llenos de nanopartículas en tejidos sintéticos y reales. Al generar gradientes térmicos mediante una placa calentadora, se pudo comprobar que el sistema reconstruía de forma precisa mapas tridimensionales de temperatura. Las imágenes obtenidas coincidieron con los valores esperados de simulaciones térmicas, con errores medios inferiores a 1 °C incluso en capas profundas.
Posteriormente, se extendió la validación a un modelo animal in vivo. Tras inyectar la dispersión de nanopartículas en un ratón anestesiado, se adquirieron imágenes hiperespectrales —donde cada píxel contiene información de intensidad de emisión y de forma espectral— de la vasculatura. El análisis permitió reconstruir un mapa 3D de la temperatura del sistema circulatorio, con valores promedio de 36 ± 1 °C, en concordancia con la temperatura fisiológica esperada. Este resultado constituye la primera demostración de una imagen térmica tridimensional obtenida mediante luminiscencia en un organismo vivo.
Además, la estrategia requiere únicamente un sistema de excitación láser y una cámara hiperespectral, sin equipos voluminosos. La posibilidad de trabajar con una única imagen hiperespectral agiliza el proceso, superando una de las limitaciones de las técnicas tomográficas previas.
Perspectivas futuras y aplicaciones potenciales
Más allá de la termometría, el enfoque descrito representa un modelo para desarrollar sensores tridimensionales basados en luminiscencia. Si se utilizan nanopartículas cuyas emisiones se vean moduladas por otros parámetros —como el pH o la concentración de oxígeno—, la misma estrategia podría aplicarse para obtener mapas 3D de esas variables en sistemas biológicos.
El trabajo forma parte de un esfuerzo internacional y está íntimamente conectado con el proyecto europeo MAtCHLESS, financiado por el Consejo Europeo de Investigación. El objetivo es avanzar en el diseño de sensores lumínicos de nueva generación con capacidad para monitorizar múltiples parámetros intracelulares y tisulares con una resolución sin precedentes, ampliando el alcance de la nanotermometría hacia una herramienta integral para la biomedicina.
Referencias
- Ming, L., Romelli, A., Lifante, J. et al. Luminescence-enabled three-dimensional temperature bioimaging. Nat Commun 16, 6429 (2025). doi: 10.1038/s41467-025-59681-7

Erving Ximendes
Doctor en Nanomateriales Avanzados y Nanotecnología






