A partir de los 50 años, nuestras células madre sanguíneas empiezan a mostrar una transformación silenciosa, pero decisiva: pierden diversidad. Esa pérdida, invisible a simple vista, puede aumentar el riesgo de enfermedades y se convierte en una señal precoz del envejecimiento biológico. Un equipo internacional de científicos ha conseguido leer esa transformación directamente en el ADN, abriendo una nueva era en el diagnóstico y estudio del envejecimiento.
Cada célula del cuerpo humano contiene una historia escrita no solo en su secuencia genética, sino también en las etiquetas químicas que modifican su ADN. Entre ellas, la metilación del ADN actúa como un sistema de "interruptores" que regula qué genes se activan o silencian. Ahora, científicos del Centro de Regulación Genómica (CRG) en Barcelona y del Instituto de Investigación Biomédica de Barcelona (IRB) han demostrado que esas marcas también pueden funcionar como códigos de barras naturales que permiten rastrear el origen de cada célula sanguínea a lo largo del tiempo.
El estudio, publicado en la revista Nature en 2025, introduce EPI-Clone, una técnica pionera capaz de identificar qué clones celulares dominan la producción de sangre en distintas etapas de la vida. Por primera vez, ha sido posible rastrear sin manipulación genética cuántas células madre participan realmente en la renovación sanguínea, y cómo este proceso se transforma con el envejecimiento.

Un ecosistema clonal que cambia con la edad
En la juventud, el sistema hematopoyético —responsable de la producción de células sanguíneas— funciona como un ecosistema diverso y equilibrado. Decenas de miles de células madre hematopoyéticas (HSCs) trabajan simultáneamente para producir glóbulos rojos, blancos y plaquetas. Esta diversidad es fundamental para mantener una respuesta inmunitaria eficaz frente a patógenos y para evitar fallos en la producción celular.
Con el paso de los años, esa diversidad disminuye drásticamente. El estudio revela que a partir de los 50 años, algunas células madre empiezan a desaparecer del proceso de producción. Mientras tanto, otras se expanden de forma clonal, es decir, generan la mayor parte de las nuevas células sanguíneas. Este fenómeno se vuelve casi universal a los 60.
Esa pérdida de diversidad tiene consecuencias directas en la salud. Un sistema dominado por pocos clones es más vulnerable a mutaciones, menos flexible frente al estrés biológico y más proclive a enfermedades ligadas al envejecimiento como la leucemia o la inflamación crónica.
"Sigue el ritmo como un reloj”, dijo el Dr. Indranil Singh, autor del estudio e investigador del IRB Barcelona y del Broad Institute de Harvard y MIT. "A los 50 años, ya se puede ver que empieza, y después de los 60, parece casi inevitable".
Trazando la historia de cada célula
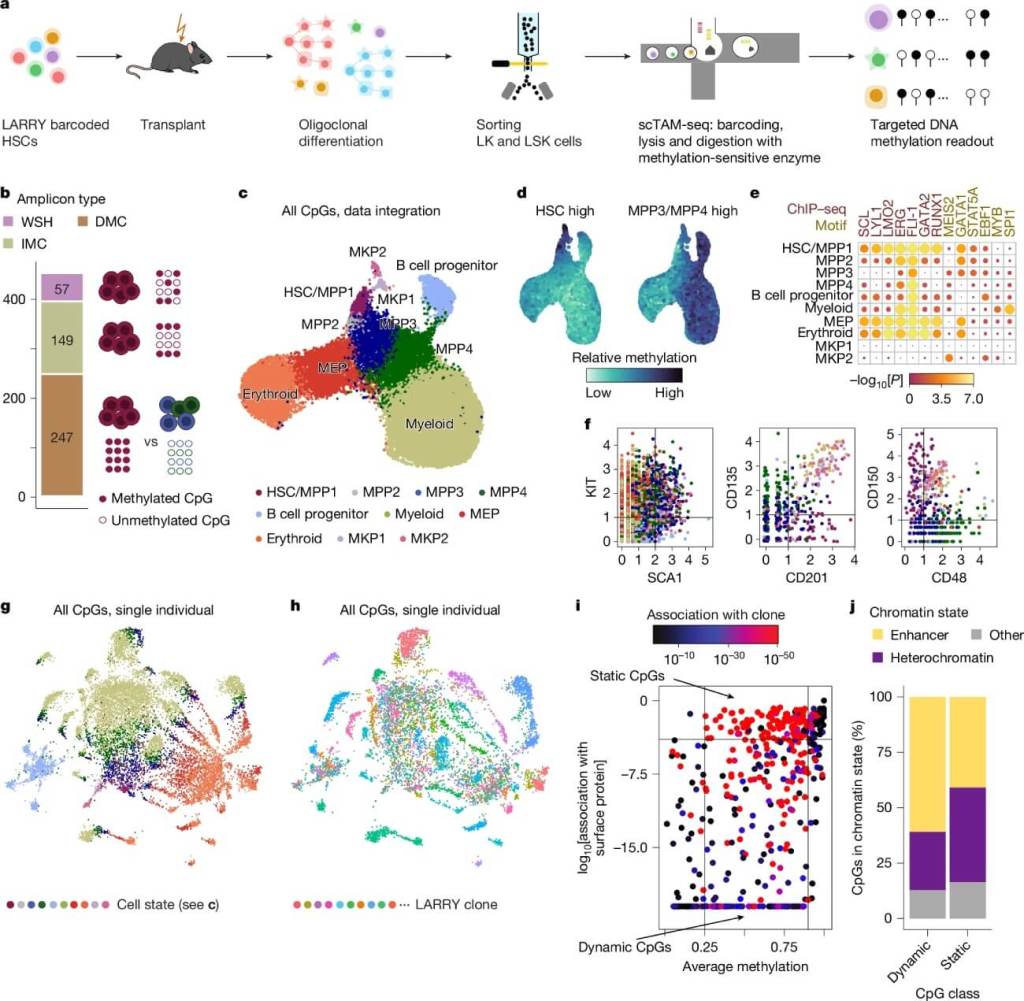
Para descifrar este cambio, los investigadores desarrollaron EPI-Clone, un método que utiliza patrones de metilación del ADN como códigos de barras naturales. A diferencia de los enfoques clásicos que requieren modificar genéticamente a las células, esta técnica es aplicable en humanos y permite analizar cientos de miles de células individuales.
Cada célula hija hereda las marcas epigenéticas de su célula madre. Esto significa que es posible reconstruir el árbol genealógico de cada célula en el organismo. Aplicado a sangre de ratones y humanos, EPI-Clone permitió identificar qué clones se habían expandido, cuáles habían desaparecido y cuál era la composición funcional de cada uno.
"Nuestras células portan cambios genéticos que colectivamente nos hacen individuos únicos. Pero dentro de cada individuo, llevamos también un mosaico de alteraciones genéticas y epigenéticas. Estas alteraciones se heredan dentro de cada familia de células que, aunque acaben realizando diferentes funciones, comparten las marcas que las vinculan a una célula madre ancestral común", dijo el Dr. Alejo Rodríguez-Fraticelli, autor del estudio e investigador ICREA del IRB Barcelona.
"Por fin, hemos podido construir el árbol genealógico epigenético leyendo la información escrita directamente en el ADN de cada célula".
Con esta información, los científicos pudieron ver que muchos de los clones dominantes en personas mayores tenían una preferencia por la producción de células mieloides, ligadas a la inflamación. Esa inclinación podría explicar fenómenos como el "inflammaging" —una inflamación crónica de bajo grado asociada al envejecimiento.
La sangre revela su relación con enfermedades
Uno de los hallazgos más sorprendentes fue que muchos clones expandidos no tenían mutaciones cancerígenas conocidas. Aunque algunos sí mostraban mutaciones asociadas a la hematopoyesis clonal (CH), otros parecían expandirse por mecanismos aún desconocidos. Esto sugiere que la pérdida de diversidad y el dominio clonal no son simplemente precursores del cáncer, sino también marcas generales del envejecimiento.
Esta distinción es clave para el diagnóstico preventivo. La posibilidad de identificar clones problemáticos antes de que provoquen síntomas permite anticiparse a enfermedades como leucemia, accidentes cardiovasculares o trastornos inmunitarios. Además, podría ayudar a diferenciar entre envejecimiento saludable y envejecimiento patológico.
La herramienta también podría mejorar la selección de terapias, enfocándose en eliminar clones disfuncionales o en restaurar la diversidad del sistema hematopoyético para mejorar la salud inmunitaria en adultos mayores.
Una oportunidad para estudiar rejuvenecimiento humano
Hasta ahora, las terapias de rejuvenecimiento hematopoyético solo habían sido evaluadas en modelos animales. Pero este modelo podría facilitar su estudio en humanos, ya que permite identificar de forma natural y sin modificación genética los clones más activos o perjudiciales.
Por ejemplo, estudios previos en ratones han demostrado que eliminar clones con sesgo mieloide puede restaurar la producción de linfocitos y mejorar la respuesta inmunitaria. Detectar clones similares en humanos podría abrir el camino a intervenciones específicas, personalizadas y más eficaces.
"No podemos arreglar lo que no podemos ver y, por primera vez, EPI-Clone puede facilitar esto para los humanos", dijo el Dr. Lars Velten, jefe de grupo en el Centro de Regulación Genómica (CRG) y autor del estudio.
"Si queremos pasar de los tratamientos genéricos anti-envejecimiento a la verdadera medicina de precisión para el envejecimiento, esta es exactamente la herramienta que necesitamos", dijo Velten.
Esta estrategia se alinea con los principios de la medicina de precisión: no tratar de forma genérica el envejecimiento, sino intervenir según las características individuales de cada sistema hematopoyético. El futuro del rejuvenecimiento podría depender de herramientas como esta.

El reloj biológico está en la sangre
El estudio marca un antes y un después en la comprensión del envejecimiento sanguíneo. Gracias a EPI-Clone, ahora sabemos que la pérdida de diversidad clonal comienza mucho antes de que se presenten los síntomas de las enfermedades relacionadas con la edad.
Este hallazgo podría transformar la forma en que se diagnostica y se previenen enfermedades como el cáncer, las infecciones recurrentes o la inflamación crónica. También proporciona un marco para estudiar intervenciones que puedan revertir, frenar o ralentizar el deterioro del sistema inmunitario.
A medida que la ciencia avanza hacia una medicina más personalizada, este tipo de herramientas podrían convertirse en pilares para entender y tratar el envejecimiento como un proceso biológico modificable.
Referencias
- Scherer, M., Singh, I., Braun, M.M. et al. Clonal tracing with somatic epimutations reveals dynamics of blood ageing. Nature (2025). doi: 10.1038/s41586-025-09041-8