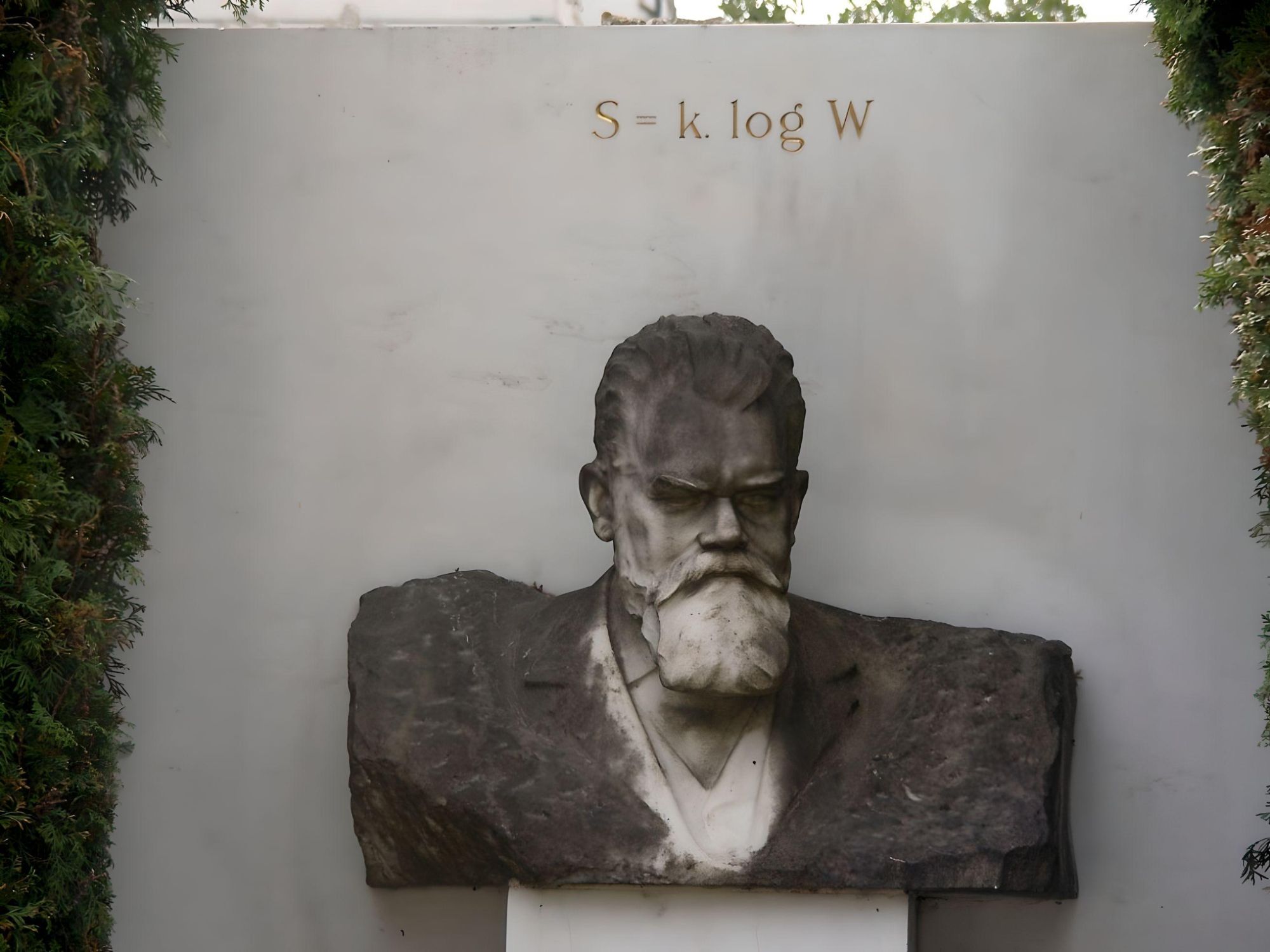Los turistas no avisados que se adentran en el cementerio de Viena pueden darse de bruces con una tumba que en la lápida hay inscrita una extraña ecuación: S = k. log W. Tan peculiar epitafio se encuentra en la tumba de Ludwig Boltzmann. Este austriaco duerme el sueño eterno junto a grandes personalidades de la música clásica, desde la familia Strauss hasta Brahms, pasando por el mismísimo Beethoven. Sin embargo, Boltzmann no tenía nada de que ver con la música, ni falta que le hacía: fue una persona de enorme popularidad y prestigio en su campo, siendo uno de los principales físicos en la transición del siglo XIX al siglo XX que realizó importantes aportaciones a la mecánica estadística, un área muy técnica de la física.
Boltzmann era hijo de un recaudador de impuestos vienés. De mente lúcida y brillante, fue profesor en Heildelberg, Berlín y Viena. Su carácter presentaba el mismo comportamiento que una veleta: unos días se sentía deprimido, otros irritable y otros alegre y ligero como un colegial. Hasta su aspecto físico cuadraba perfectamente con su personalidad; era corto de estatura, corpulento y de pelo rizado: “Mi dulce, gordo cariño” le susurraba su mujer al oído.
La fórmula del desorden
La fórmula de la tumba permite calcular la entropía de un sistema, un concepto interesante al tiempo que misterioso. Relaciona la entropía de un sistema (S) con el número de las posibles disposiciones o estados de las partículas que lo constituyen (W) y con una constante (k) que lleva el nombre de Boltzmann. Las implicaciones que esta ecuación tiene en nuestro mundo son del orden, por no decir superiores, a la famosa ecuación de Einstein que todo el mundo conoce, la energía es igual a la masa por la velocidad de la luz al cuadrado.
Veamos lo que significa el término W. Imaginemos que tenemos seis monedas. Las metemos en un cubilete, lo agitamos y las lanzamos sobre la mesa. En este caso W está representado por el número de maneras distintas en que pueden aparecer una, dos, tres, cuatro, cinco o seis caras. No importa cómo hayan salido, sólo importa el número de caras y de cruces: ese es el estado del sistema. En el caso de un gas W representa el número posible de estados en que puede encontrarse y que nos dan los mismos valores de presión, energía interna, temperatura, volumen... En definitiva W es el número de maneras que se puede organizar internamente un sistema sin que un observador externo aprecie diferencia alguna.
Pensemos ahora en una baraja. Podemos poner las cartas de una baraja de 1048 (un 1 seguido de 48 ceros) formas posibles, que serían todos estados en que pueden estar las las moléculas de un gas. Y si la mayoría de las veces la baraja aparece desordenada ante nuestro ojos igual ocurre con los gases: el estado más probable de las partículas de un gas es el de desorden. Pero, ¿qué significa orden en un gas? En la baraja es fácil decirlo pues corresponde a una disposición que nos llama particularmente la atención: por ejemplo, ordenada por palo y número.

Para un gas viene a ser algo parecido: todas las moléculas moviéndose en la misma dirección o dos gases que, contenidos en el mismo recipiente, no estén mezclados sino separados, o que un gas se encuentre comprimido en una esquina dejando el resto totalmente vacío...
Todas estas configuraciones pueden suceder, no hay ninguna ley que lo impida. Sin embargo, esto es altamente improbable, más incluso que tras mezclar una baraja salga ordenada por número y palo. Por algo muy sencillo y que no debe dejar de repetirse: hay un mayor número de combinaciones desordenadas que ordenadas. Por tanto, como W define el número de situaciones microscópicas relacionadas con una macroscópica, y como son más probables las situaciones desordenadas, entonces W está relacionado con el desorden del sistema. A mayor desorden, mayor valor de W. De todo lo dicho la conclusión es obvia: la situación más probable de un gas es la de desorden.
El significado de la entropía
Ahora ya estamos en condiciones de entender lo que es la entropía: una medida del desorden en la naturaleza. Y como el desorden es más probable que el orden, la entropía tiende a aumentar. Pero eso no implica que la entropía siempre tenga que aumentar: lo que dijo Boltzmann es que la disminución de la entropía no es imposible sino altamente improbable. En definitiva, que puede suceder que un vaso roto se recomponga o que el calor pase del cuerpo frío al caliente. Claro que puede que no viéramos eso ni aunque pasaran varias veces la edad actual del universo...

Esta fue la obra de Boltzmann. Estableció un vínculo entre las propiedades que medimos de la materia y el comportamiento de las partículas que la componen, los átomos. Y no sólo eso. Su ecuación refleja otro aspecto esencial: todo lo que sucede en el universo conlleva un aumento de entropía. Ahí reside la fuerza de la ecuación de Boltzmann: da cuenta y razón de la degradación de todo lo existente.
Boltzmann, aunque corto de vista, percibió mucho más lejos que sus colegas, que no acababan de creerse que los átomos realmente existían. Muchos dudaron de sus argumentos porque creían que el universo tenía una finalidad, un propósito, y su evolución no era el fruto de simples colisiones azarosas. Se volvía a repetir el triste camino que otros investigadores antes que él habían recorrido.
En el verano de 1906 decidió marchar de vacaciones a Trieste con su mujer y su hija, pero a medida que se acercaban la fecha, Bolzmann cayó en una de sus profundas depresiones. El cálido sol del Mediterráneo hace milagros, y Boltzmann parecía mejorar de su postración, quizá ocasionada por no ver reconocido el fruto de su trabajo. Pero un día, cuando las dos mujeres de su vida se estaban dando un baño, todo acabó para siempre. Boltzmann se ahorcó. Tenía 62 años.
Irónicamente, hacía menos de un año que un joven trabajador de una oficina de patentes de Suiza llamado Albert Einstein había publicado un artículo en la revista Anales de física donde demostraba que aplicando la teoría de Boltzmann se podía explicar el movimiento errático de un grano de polen en el agua, un misterio que había permanecido sin resolver desde 1828. Y si hubiese esperado unos pocos meses más hubiese recibido la noticia de que el francés Jean Baptiste Perrin había confirmado experimentalmente su teoría.
La impagable publicidad que Perrin dio a la teoría cinética de Boltzmann, unida a los no menos impresionantes resultados obtenidos, hizo que los científicos empezaran a verla cada vez con mejores ojos. Por todo ello, Perrin fue recompensado con el premio Nobel en 1926, Einstein fue reconocido como una de las mentes más grandes de este siglo y Boltzmann pudo descansar en su tumba. Siempre que esto sea posible.