La tuberculosis es la principal causa de muerte por enfermedad infecciosa, por encima de la COVID-19. Solo en 2023, fue responsable de 1,25 millones de muertes en el mundo (1). El agente causal de esta enfermedad son las micobacterias del Complejo Mycobacterium tuberculosis (CMTB), siendo la especie Mycobacterium tuberculosis la principal causante de la tuberculosis en humanos. Sin embargo, existen otras especies en este grupo, como Mycobacterium bovis y Mycobacterium caprae, causantes de la tuberculosis en animales y capaces de transmitirse a los humanos por distintas vías, desde la respiratoria a la alimentaria. Aunque son evolutivamente más recientes que M. tuberculosis, se han identificado restos humanos de la Edad del Bronce con evidencia de tuberculosis zoonótica causada por M. bovis (2). Los principales hospedadores animales son el ganado bovino y caprino, respectivamente, aunque otras especies domésticas y silvestres también pueden actuar como reservorio de esta enfermedad (3).
En animales, el carácter crónico de la enfermedad, la complejidad de su diagnóstico y una epidemiología que involucra a múltiples hospedadores la convierten en un reto importante para su control. Si bien es cierto que los programas de control y erradicación en el ganado bovino, las inspecciones en los mataderos y las estrictas medidas de seguridad alimentaria han reducido considerablemente el riesgo de transmisión de esta enfermedad en contextos como el español (4), aún quedan muchos interrogantes sobre cómo se mantienen y desarrollan las cadenas de transmisión entre humanos y animales.
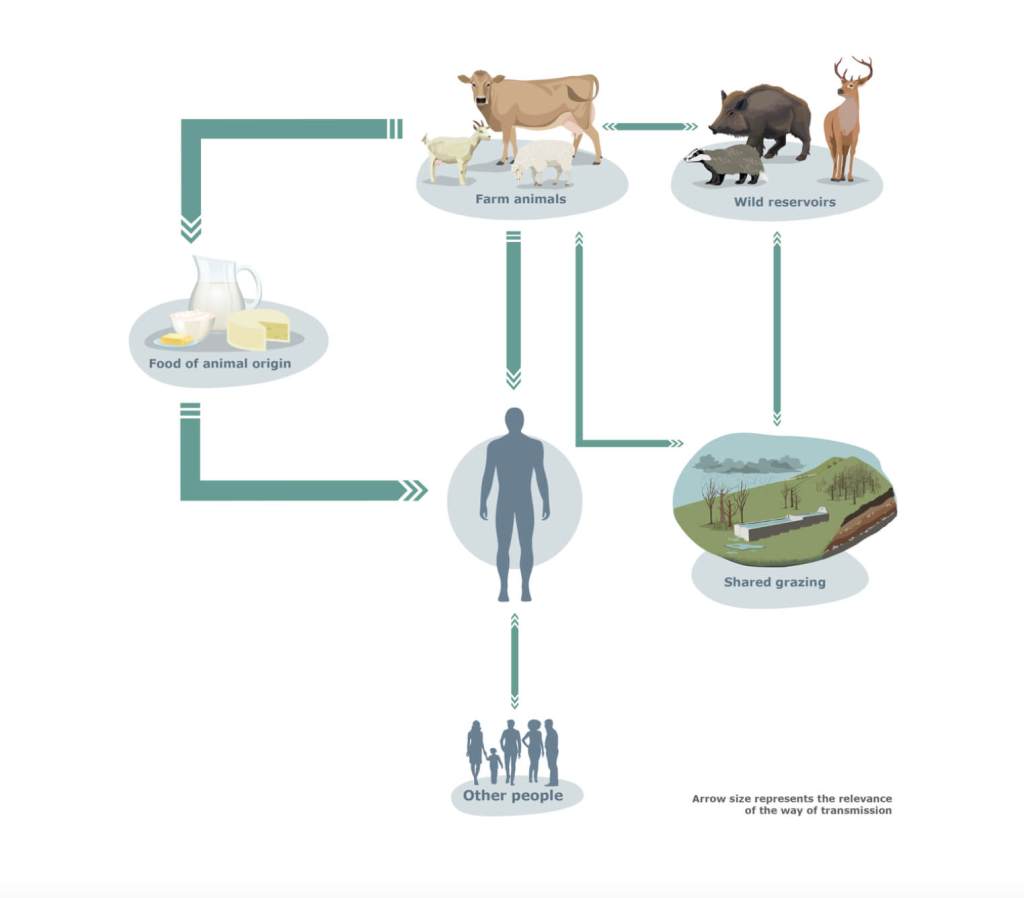
La tuberculosis zoonótica es un buen ejemplo de enfermedad capaz de saltar de especie y emerger como un problema de salud pública, dejando patente la importancia que tiene el enfoque One Health o Una Salud en el estudio de estas amenazas para la salud de la población. One Health es un enfoque integral y multidisciplinar que busca equilibrar y optimizar la salud de las personas, los animales y los ecosistemas. Para lograrlo, es fundamental comprender las estrechas interconexiones e interdependencias entre estos tres ámbitos, con el fin de desarrollar nuevas estrategias de vigilancia, prevención y control de enfermedades. Teniendo en cuenta que aproximadamente el 60 % de las enfermedades infecciosas conocidas y hasta el 75 % de las enfermedades infecciosas emergentes son de origen zoonótico (5, 6), es necesario desarrollar e implementar este enfoque en el abordaje de dichas amenazas para la salud pública.
¿Cuál es la situación de la tuberculosis en animales y de la tuberculosis zoonótica en humanos en España?
En 2023, la prevalencia de la tuberculosis en el ganado bovino fue del 1,5 % en los rebaños españoles, la segunda más alta de la Unión Europea, aunque con variaciones significativas entre las distintas comunidades autónomas. Si bien es cierto que en los últimos años ha aumentado el número de provincias libres de tuberculosis bovina, aún hay comunidades autónomas del sur peninsular, como Andalucía, Castilla-La Mancha y Extremadura, que en 2023 registraron incidencias superiores al 3 % a nivel de rebaño. En estas regiones, caracterizadas por la ganadería extensiva y una alta densidad de reservorios silvestres, la erradicación de la enfermedad representa un desafío importante para las autoridades de sanidad animal. Respecto a la tuberculosis en especies silvestres a nivel nacional, en 2017 se aprobó el Plan de Actuación sobre Tuberculosis en Especies Silvestres (PATUBES), que refleja la necesidad de establecer actuaciones conjuntas que mantengan un equilibrio entre la situación sanitaria, la actividad cinegética y la conservación de la biodiversidad (7). Según los últimos datos de vigilancia del PATUBES, el jabalí, el ciervo común y el gamo europeo son los principales reservorios silvestres de la tuberculosis animal en la península ibérica (8).
En humanos, los datos sobre la incidencia de tuberculosis zoonótica presentan una imagen fragmentada y parcial en nuestro territorio. La principal limitación es que existe una baja tasa de identificación de la especie de micobacteria responsable de los casos de tuberculosis en España y en la Unión Europea, lo que dificulta conocer su magnitud real. Incluso contando con esta limitación, España es el país de la Unión Europea que notifica el mayor número de casos de tuberculosis zoonótica, con una tasa de incidencia de un caso confirmado por cada millón de habitantes en 2023 (9).
Si bien los casos zoonóticos parecen representar solo una pequeña proporción de los casos de tuberculosis que se notifican en nuestro país (alrededor de 8 casos por 100.000 habitantes al año) (10), este tipo de tuberculosis representa un reto importante en su abordaje clínico y a la hora de desarrollar medidas de salud pública. Por ejemplo, parece afectar más a personas mayores y se asocia con frecuencia a formas extrapulmonares, más difíciles de diagnosticar y tratar. Además, los laboratorios de los hospitales donde habitualmente se realiza el diagnóstico de esta enfermedad carecen con frecuencia de los métodos moleculares adicionales necesarios para distinguir las especies. A pesar de los retos existentes, hay muy pocos estudios en nuestro país que investiguen las principales vías de transmisión a los humanos o los factores de riesgo implicados en la interfaz humano-animal-medio ambiente.
Un nuevo trabajo enmarcado en un proyecto One Health arroja luz sobre la incidencia, las características clínicas, la distribución geográfica y la evolución temporal de la tuberculosis zoonótica en España
El Centro Nacional de Epidemiología (CNE) y el Centro Nacional de Microbiología (CNM) del Instituto de Salud Carlos III (ISCIII) están liderando un proyecto que tiene como objetivo principal diseñar una estrategia One Health para mejorar la vigilancia y el control de la tuberculosis zoonótica. En este proyecto también colaboran el Ministerio de Sanidad, el Ministerio de Agricultura, Pesca y Alimentación, el Centro de Vigilancia Sanitaria Veterinaria (VISAVET) de la Universidad Complutense de Madrid y cuatro comunidades autónomas.
El primer estudio derivado de este proyecto se ha publicado recientemente en la revista Emerging Infectious Diseases (11), de los Centros para el Control y la Prevención de Enfermedades de EE.UU. Este primer artículo revela las características clínicas, distribución geográfica y evolución temporal de los casos de tuberculosis zoonótica en España entre 2018 y 2022. La investigación dibuja el primer ‘mapa’ de la tuberculosis zoonótica en España, ofreciendo información sobre la incidencia por edad y sexo de las personas afectadas, tipos de lesiones y datos de coinfección por VIH, entre otras cuestiones.
Respecto a los resultados, destacan las diferencias en el perfil de los casos por M. bovis y M. caprae si los comparamos con la tuberculosis no zoonótica, ya que la tuberculosis zoonótica afecta más a personas de edad avanzada, nacidas en España y presenta un porcentaje elevado de formas extrapulmonares. Respecto a su patrón geográfico, observamos que la distribución de los casos en humanos no coincide con la distribución de casos en bovinos; por ejemplo, es precisamente en la zona noroeste donde se concentran más casos humanos, a pesar de ser el área que concentra la mayoría de las provincias oficialmente libres de tuberculosis bovina.

¿Qué preguntas quedan por responder?
Una vez descritas las características de los casos, así como la distribución y evolución de la incidencia de la tuberculosis zoonótica, el siguiente paso será determinar si existen vínculos entre las cepas circulantes aisladas en humanos y en animales. Esto nos permitirá conocer mejor las cadenas de transmisión entre humanos y animales, y así poder dar respuesta a algunos de los principales interrogantes que existen en relación con esta enfermedad potencialmente emergente. Para ello, será clave el uso de técnicas de secuenciación masiva. Estas técnicas nos permitirán identificar las cepas que forman parte de un mismo brote e, incluso, reconstruir la cadena de transmisión de la infección a lo largo del tiempo, para así conocer mejor cómo se contagian los humanos de estas especies predominantes en el mundo animal.
La primera cuestión por responder sería si los nuevos casos de tuberculosis zoonótica en España se tratan de nuevas infecciones o reactivaciones de viejas infecciones, pues la tuberculosis puede prevalecer en un estado latente durante años. Para ello, será determinante la secuenciación del genoma completo de cepas aisladas de animales que compartan un perfil genético similar, una misma área geográfica o un vínculo epidemiológico con cepas aisladas en humanos, dentro de una ventana temporal razonable.
La segunda pregunta que debe plantearse es, bien se trate de una transmisión reciente o de una infección antigua, ¿cuáles son o fueron los factores de riesgo asociados a estas infecciones? Para responderla, se llevará a cabo un estudio prospectivo de casos y controles, empleando encuestas epidemiológicas. A partir de los resultados obtenidos en las distintas fases, se elaborará una propuesta de vigilancia integral One Health, piloto en nuestro país y con un gran potencial, ya que podría utilizarse en otras enfermedades infecciosas de origen zoonótico. Para alcanzar estos objetivos es imprescindible tender puentes y encontrar un lenguaje común entre salud humana, salud animal y salud ambiental, lo que constituye un gran reto, pero también una oportunidad única para mejorar la salud de todos.
Referencias
- (1) Organización Mundial de la Salud. Informe global de la tuberculosis 2024. https://www.who.int/teams/global-programme-on-tuberculosis-and-lung-health/tb-reports/global-tuberculosis-report-2024
- (2) Taylor GM, Murphy E, Hopkins R, Rutland P, Chistov Y. First report of Mycobacterium bovis DNA in human remains from the Iron Age. Microbiology (Reading). 2007 Apr;153(Pt 4):1243-1249.
- (3) Rodríguez S, Bezos J, Romero B, de Juan L, Álvarez J, Castellanos E, Moya N, Lozano F, Javed MT, Sáez-Llorente JL, Liébana E, Mateos A, Domínguez L, Aranaz A; Spanish Network on Surveillance and Monitoring of Animal Tuberculosis. Mycobacterium caprae infection in livestock and wildlife, Spain. Emerg Infect Dis. 2011 Mar;17(3):532-5.
- (4) Marco normativo de la Unión Europea sobre tuberculosis animal: Reglamento de Ejecución (UE) 2018/1882 de la Comisión, de 3 de diciembre de 2018; El Reglamento (UE) 2016/429 del Parlamento Europeo y del Consejo, de 9 de marzo de 2016; El Reglamento Delegado (UE) 2020/689 de la Comisión, de 17 de diciembre de 2019; El Reglamento Delegado (UE) 2020/688 de la Comisión, de 17 de diciembre de 2019; Reglamentos (CE) 852/2004, 853/2004 y 882/2004. Legislación nacional sobre tuberculosis animal: la Ley 8/2003, de sanidad animal y el Real Decreto 2611/1996, de 20 de diciembre, y sus modificaciones, por el que se regulan los programas nacionales de erradicación de enfermedades de los animales; así como el Real Decreto 1440/2001.
- (5) Woolhouse ME, Gowtage-Sequeria S. Host range and emerging and reemerging pathogens. Emerg Infect Dis. 2005;11:1842–7.
- (6)Jones KE, Patel NG, Levy MA, Storeygard A, Balk D, Gittleman JL, et al. Global trends in emerging infectious diseases. Nature. 2008;451:990–3.
- (7) Ministerio de Agricultura, Pesca y Alimentación. Plan de actuación sobre tuberculosis en especies silvestres (PATUBES). 2017. https://www.mapa.gob.es/dam/mapa/contenido/ganaderia/temas/sanidad-animal-e-higiene-ganadera/sanidad-animal/enfermedades/bovino/tuberculosis-bovina/patubes2017_3.pdf
- (8) Ministerio de Agricultura. Pesca y Alimentación. Informe del programa de vigilancia y del programa de erradicación de la tuberculosis bovina en España. 2023. https://www.mapa.gob.es/dam/mapa/contenido/ganaderia/temas/sanidad-animal-e-higiene-ganadera/sanidad-animal/enfermedades/bovino/tuberculosis-bovina/informes/web_informetb2023final_2.pdf
- (9) European Food Safety Authority (EFSA); European Centre for Disease Prevention and Control (ECDC). The European Union One Health 2023 Zoonoses report. EFSA J. 2024;22:e9106.
- (10) Centro Nacional de Epidemiología, Instituto de Salud Carlos III. Informes epidemiológicos sobre la situación de la tuberculosis en España. 2015-2023. https://cne.isciii.es/en/servicios/enfermedades-transmisibles/enfermedades-a-z/tuberculosis.
- (11) Roy Á, Gómez-Barroso D, Cruz-Ferro E, Fernández A, Martínez-Pino I, Del Henar Marcos M, Ursúa-Díaz I, Miras S, Echave N, Ounarou E, Romero B, Herrera-León L, Herrador Z; Study Group on Zoonotic Tuberculosis. Spatiotemporal Distribution and Clinical Characteristics of Zoonotic Tuberculosis, Spain, 2018-2022. Emerg Infect Dis. 2025 Jul;31(7):1344-1352. doi: 10.3201/eid3107.250031

Álvaro Roy Cordero
Doctor en Veterinaria. Investigador del ISCIII


Laura Herrera-León
Doctora en Ciencias Biológicas. Investigadora del Instituto de Salud Carlos III


Zaida Herrador Ortiz
Doctora en Medicina, Médico especialista en Medicina Preventiva y Salud Pública. Investigadora del Instituto de Salud Carlos III