El diagnóstico de cáncer depende en gran medida de biopsias, imágenes y análisis histológicos. Sin embargo, en muchos casos, estos métodos resultan invasivos, poco concluyentes o imposibles de realizar sin riesgos, como sucede con ciertos tumores cerebrales. La identificación precisa del tipo de tumor es esencial para elegir el tratamiento adecuado, pero en situaciones donde no es posible obtener una muestra completa o representativa, el diagnóstico puede retrasarse o ser incorrecto.
En este contexto, la epigenética se ha convertido en una aliada poderosa. Se trata del conjunto de modificaciones químicas que no cambian el ADN en sí, pero que determinan qué genes se activan o se silencian en cada célula. Estas “huellas epigenéticas” permiten distinguir entre diferentes tipos de tumores, ya que cada uno presenta patrones únicos de metilación del ADN, especialmente en regiones específicas como las islas CpG o los promotores génicos.
El nuevo modelo desarrollado por investigadores de la Universidad Charité de Berlín y del Instituto Alemán del Cáncer (DKTK) utiliza estos patrones epigenéticos para clasificar tumores de manera precisa, incluso cuando los datos provienen de diferentes tecnologías de secuenciación o son incompletos. La clave está en una red neuronal que aprende a reconocer estos patrones sin necesidad de un análisis exhaustivo del genoma completo, lo que reduce tiempo, costos y complejidad.

crossNN: una inteligencia artificial entrenada para reconocer más de 170 tipos de cáncer
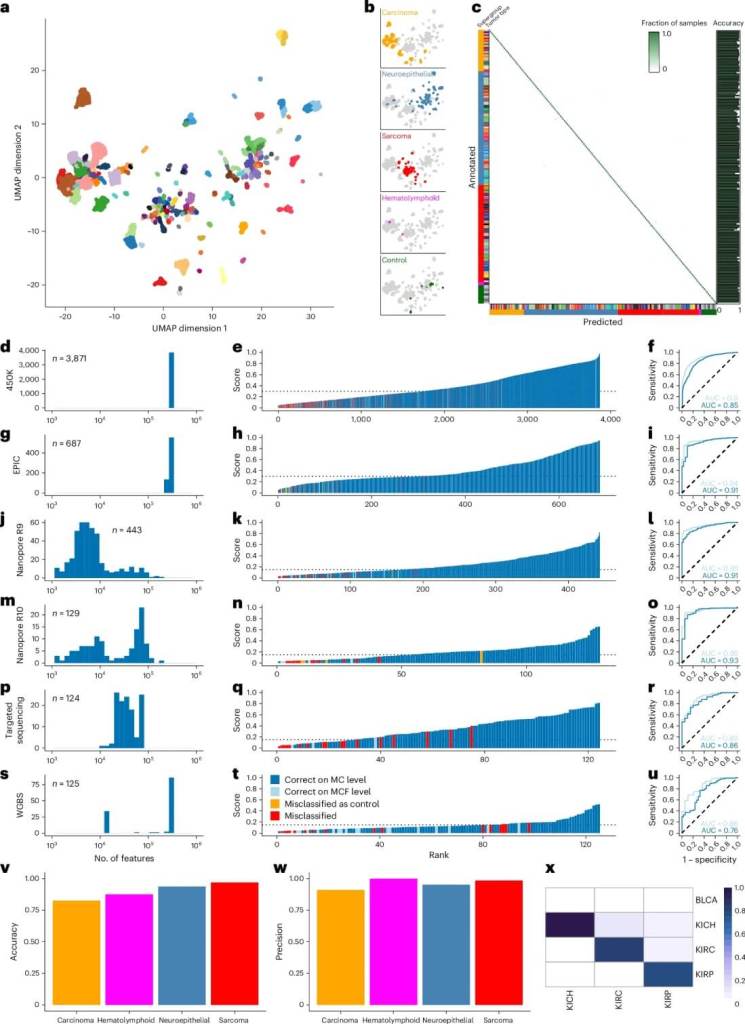
El modelo, llamado crossNN, fue entrenado con los perfiles epigenéticos de más de 8.000 tumores de referencia. Esta base de datos incluía 82 subtipos de tumores cerebrales y otros 178 tipos tumorales de distintos órganos, lo que permitió al sistema aprender una enorme variedad de firmas moleculares.
Durante la validación, crossNN alcanzó una precisión del 97,8 % a nivel global y del 99,1 % en tumores cerebrales, incluso usando muestras de baja calidad o tomadas con técnicas diferentes.
"Esto significa que se puede usar para cánceres de todos los órganos, además de los tumores cerebrales relativamente raros", dijo Philipp Euskirchen, jefe del estudio y científico en el Consorcio Alemán del Cáncer y el Instituto de Neuropatología de Charité.
Una de las grandes fortalezas del sistema es su versatilidad. Puede analizar datos provenientes de tecnologías muy distintas, como microarrays de metilación, secuenciación por nanoporo, secuenciación de bisulfito o paneles dirigidos. A pesar de la variabilidad en la calidad y cobertura de estas técnicas, crossNN logró mantener un rendimiento muy alto en todos los casos.
Para lograr esto, los investigadores desarrollaron un sistema de entrenamiento basado en máscaras aleatorias y codificación binaria, donde los sitios de metilación se codifican como 1 (metilado), -1 (no metilado) o 0 (no detectado). Esta estrategia permitió que la red neuronal aprendiera a reconocer patrones robustos, incluso con datos incompletos o dispersos, una característica fundamental para su uso clínico en condiciones reales.
Precisión y explicabilidad: el equilibrio ideal para la medicina de precisión
"Nuestro objetivo era desarrollar un modelo que clasificara con precisión los tumores, incluso si solo se basan en partes de todo el epigenoma tumoral o los perfiles se recogieron por medio de diferentes técnicas y diversos grados de precisión", explicó Sören Lukassen, bioinformático y autor del estudio.
Uno de los grandes desafíos de los modelos de inteligencia artificial en medicina es su “caja negra”: muchos ofrecen resultados sin que los médicos puedan entender cómo llegaron a ellos. crossNN fue diseñado para evitar este problema, gracias a su arquitectura simple y completamente explicable. Se basa en una red neuronal de una sola capa, lo que permite interpretar qué características del ADN están influyendo en cada clasificación.
Esto significa que los médicos pueden saber exactamente qué sitios del genoma están siendo utilizados por el modelo para identificar un tumor concreto, lo que facilita la validación clínica y la confianza en sus predicciones.
Además, la explicación de los resultados ayuda a descubrir nuevos biomarcadores epigenéticos que podrían tener relevancia terapéutica o diagnóstica en el futuro.
Un avance clave para los tumores cerebrales y los cánceres de origen desconocido
Los tumores cerebrales son especialmente difíciles de clasificar con métodos tradicionales. crossNN ha demostrado su capacidad para diagnosticar este tipo de tumores incluso a partir de líquido cefalorraquídeo extraído mediante punción lumbar, evitando la necesidad de intervenciones quirúrgicas para obtener tejido tumoral. Esto representa un gran avance en términos de seguridad, rapidez y acceso a tratamientos tempranos.
Además, el modelo puede ser utilizado para los llamados "cánceres de origen primario desconocido", aquellos en los que no se puede identificar el lugar de origen del tumor.
Al analizar el patrón de metilación del ADN, crossNN puede inferir el tejido de origen con gran precisión, lo que permite diseñar terapias más específicas y mejorar el pronóstico de estos pacientes.
También ha demostrado ser útil para distinguir entre tumores con perfiles moleculares muy similares, como diferentes tipos de carcinoma renal. Aunque en algunos casos se observaron confusiones, la precisión general del modelo sigue siendo superior a la de otros métodos disponibles.
Compatible con la clínica: rápido, escalable y listo para su implementación
Otro aspecto destacado del modelo es su eficiencia. crossNN puede generar predicciones en segundos, lo que lo hace ideal para aplicaciones en tiempo real, como durante una cirugía o en decisiones clínicas urgentes.
También está preparado para integrarse en flujos de trabajo hospitalarios, ya que puede ejecutarse en plataformas locales o a través de una interfaz web abierta.
Su arquitectura ligera permite entrenarlo rápidamente con nuevas bases de datos de referencia, lo que lo convierte en una herramienta adaptable a distintos contextos clínicos, laboratorios y países. Además, al ser compatible con las nuevas plataformas de microarrays como EPICv2, asegura su uso en la vanguardia tecnológica de la medicina molecular.
El equipo de investigadores planea ahora ensayos clínicos en los ocho centros del consorcio alemán del cáncer (DKTK) para validar su uso en la práctica médica y avanzar hacia una implementación generalizada en hospitales y centros de diagnóstico de todo el mundo.
Epigenética, IA y un nuevo horizonte para el diagnóstico del cáncer
Este avance representa una intersección extraordinaria entre inteligencia artificial, epigenética y medicina personalizada. Este modelo no solo mejora la precisión diagnóstica, sino que también ofrece una herramienta explicable, versátil y accesible para enfrentar el reto del diagnóstico tumoral moderno.
Los investigadores consideran que, en un futuro próximo, esta tecnología podría integrarse en el arsenal clínico estándar, haciendo que la clasificación de tumores sea más rápida, segura y adaptada a cada paciente.
La posibilidad de realizar diagnósticos no invasivos, con alta precisión y en tiempo real, abre nuevas puertas para detectar cánceres que antes eran difíciles de identificar o mal clasificados. Gracias a este modelo, la medicina de precisión se convierte en una realidad más cercana para miles de personas en todo el mundo.
Referencias
- Yuan, D., Jugas, R., Pokorna, P. et al. crossNN is an explainable framework for cross-platform DNA methylation-based classification of tumors. Nat Cancer (2025). doi: 10.1038/s43018-025-00976-5